Легкие металлы – перечень, свойства и польза элементов
В настоящее время такое понятие, как «легкие металлы», отсутствует в номенклатуре ИЮПАК. Таковыми принято называть металлы, имеющие небольшую плотность (как правило до 4,5 г/см3) или вес. Стоит отметить, что в настоящее время существуют такие металлы, которые легко держатся на воде, а некоторые из них имеют вес, в разы меньший пенопласта, но при этом все равно остаются достаточно прочными.

Группа легких металлов, как правило, включает в себя следующие: алюминий, олово, магний, титан, бериллий и литий. Кроме этого, к данной группе металлов часто также добавляют галлий, индий, таллий, висмут и кадмий.
Наиболее важными металлами данной группы с точки зрения технического применения являются алюминий, магний, титан, бериллий. Именно данные металлы служат в качестве основы сплавов. Алюминиевые сплавы являются наиболее значимой и распространенной группой, однако, не смотря на это, для специфического применения также предлагаются и материалы из титана и бериллия.
Что представляют собой
В номенклатуре IUPAC – уважаемой в мире международной организации, курирующей теорию и практику в сфере химии, термин «легкие металлы» отсутствует.
Читайте также: Оправки и пробки для установки и крепления заготовок по внутренней обработанной поверхности
Неофициально к легким металлам относятся вещества с плотностью менее 5 граммов на кубический сантиметр.
Разные списки включают пять – десять позиций.
Самое распространенное деление – по используемости:
- На этом основании выделяют пять главных: алюминий, бериллий, магний, титан, литий.
- Их дополняет «экзотика»: галлий, индий, висмут, таллий, кадмий.
Вторая группа причисляется к редким металлам.
Редкими эти элементы названы потому, что на практике используются недавно и не так широко, как традиционные материалы.
Литий (Li)
Вот и дошло дело до элемента, который является самым легким в мире металлом. Плотность лития, расположенного в периодической таблице на месте под цифрой 3, равна всего 0,5 г/см^3, что меньше этого показателя у воды, так что чистый литий не тонет. Атомная масса элемента колеблется от 6,398 до 6,997 а. е. м. в зависимости от изотопа. Открыт в 1817-м, а в металлическом виде получен спустя всего год.
Характеризуется повышенной химической активностью и потому в природе легко образует сложносоставные соединения. Пластичен, хорошо обрабатывается прокаткой и прессом. Цвет — серебристый. При комнатной температуре с кислородом реагирует слабо. Воспламенение происходит при 300 °C.

Литий, фото: https://ru.m.wikipedia.org/
В природе встречается в породообразующих минералах и в отложениях озер с сильным содержанием солей. Среди разрабатываемых месторождений наиболее известны чилийские, австралийские и аргентинские, хотя встречаются таковые и на территории других стран, в том числе Китая. В России главное скопление пород с содержанием лития — в Мурманской области. В стране с 2021 года работает в формате эксперимента установка по добыче металла из руд с низким содержанием элемента, благодаря которой процедура возможна при незначительных финансовых и трудовых затратах.
Соли лития используются при создании лазерного оборудования и оптики, в качестве окислителей и восстановителей в химпроме, а также в медицине и различных отраслях промышленности, включая текстильную (как отбеливатели), пищевую (как консерванты) и косметическую. Литиевые сплавы применяются для изготовления высокоэффективных проводников, в том числе анодов, необходимых для электролиза.
Элемент применяется также при создании аккумуляторов, в том числе и щелочных, а не только твердотельных. В малых количествах литий потребен человеческому организму, поскольку участвует в обмене веществ, а также влияет на психоэмоциональную возбудимость и иммунную защиту.
Классификация
Каждый представитель «легкой» группы относится еще к какому-нибудь сообществу.
Основанием становится не плотность, а другие физико-химические характеристики:
- Щелочные элементы – литий.
- Щелочноземельные – бериллий, магний.
- Цветные металлы – алюминий, титан, магний.
- Легкоплавкие – висмут, галлий, кадмий, таллий, индий.
- Тугоплавкие – титан, магний.
Каждый химический элемент наделен специфическими свойствами, присущими своей группе.
Как представлены в природе
На легкий металлический сегмент приходится пятая часть литосферы (по массе).
Читайте также: Самовсасывающие насосы: назначение, устройство и обзор наиболее популярных модификаций
Чаще они входят в состав руды либо минерала. Особенно химически сверхактивные элементы, например, литий. Этот самый легкий металл в природе представлен собственными минералами – лепидолитовой слюдой и сподуменом.

Сподумен



Токсичность
Несмотря на важную биологическую роль лития в нашем организме, он может быть опасным. Самый легкий металл достаточно токсичен и способен вызывать отравления. При горении он провоцирует раздражение и отёки слизистых оболочек. Если на них попадет кусочек целого металла, произойдёт то же самое.

Литий нельзя брать в руки без перчаток. Взаимодействуя с влагой в воздухе или влагой на коже, он легко вызывает ожог. С расплавленным металлом нужно быть ещё осторожнее, так как его активность повышается в разы. При работе с ним нужно помнить, что это щелочь. Уменьшить его действие на кожу можно обычным уксусом.
В организме литий повышает устойчивость иммунной системы и улучшает работу нервной системы. Но его переизбыток сопровождается головокружением, сонливостью, потерей аппетита. Отравление металлом приводит к снижению либидо, слабости в мышцах, набору веса. При этом может ухудшиться зрение, память и наступить кома. Работать с литием нужно всегда в перчатках, защитном костюме и очках.
Способы получения
Технологию выплавки легких металлов отработали к середине 19 века.
Для их получения в металлургии используется три способа:
- Электролиз расплава солей. То есть аккумуляция на электродах компонентов растворенных либо других веществ. Реакцию запускает электрический ток, пропускаемый через раствор либо расплав электролита.
- Металлотермия. Восстановление из их соединений другими, более активными металлами. Процесс проходит при повышенных температурах.
- Электротермия. Материал нагревается, затем расплавляется теплом, полученным из электрического тока.
Производство легких элементов – весьма энергоемкий процесс. Поэтому металлургические комбинаты располагают поближе к источникам энергии.
В отличие от тяжелых металлов: их базовые предприятия привязывают к месторождению.
Ценностью легких, особенно цветных металлов, обусловлен второй способ получения – переработка лома.
Свойства легких металлов
Алюминий
Алюминий является металлом, идеально сочетающим в своих характеристиках легкость и прочность. Его первооткрывателем является датский физик Ганс Эрстед, который в 1825 году восстановил хлорид алюминия амальгамой калия при воздействии высоких температур, в результате чего и выделил данный металл.
Имеет характерный серебристо-белый окрас. Плотность металла составляет 2712 кг/м3. Плавится при температуре: 6580С (для технического алюминий) и 6600С (для алюминия высокой чистоты). Удельная теплота плавления алюминия – 390 кДж/кг. Закипает при температуре 2515,80С. Имеет удельную теплоемкость 897Дж/кг*К. Обладает достаточно высокой пластичностью, которая составляет 35% у технического алюминия и 50% у чистого металла.
Первым изделием, для изготовления которого был применен алюминий, стала детская погремушка. Однако, с тех далеких времен, алюминий стал достаточно распространенным материалом. В настоящее время он нашел свое широкое применение во многих сферах человеческой деятельности. Однако, наибольший процент потребления данного металла приходится на упаковочную промышленность, особенно для банок с напитками.
Также следует отметить, что алюминий активно применяется наряду со сталью и в машиностроении. В настоящее время существует огромное множество алюминиевых сплавов, которые отвечают огромному количеству определенных и необходимых требований. Среди данных сплавов можно выделить две основные группы – литейные и деформируемые. Сплавы из каждой группы также можно разделить на те, которые способны дисперсионно твердеть и те, которые не способны. Чтобы материал сделать более прочным применяются:
Читайте также: 7 причин – почему искрят щетки электродвигателя
- наклеп;
- легирование;
- дисперсионное твердение (старение).
Для того, чтобы получить оптимальные характеристики стареющих сплавов, их необходимо подвергнуть измельчению. В связи с этим, для дисперсионного старения деформируемых сплавов используется термообработка. Ее также могут применять с целью повышения прочности.
Среди наиболее важных литейных сплавов стоит выделить Al-Si, которые образуют эвтектическую систему с эвтектической точкой при 11,7% Si и 5770С. Сплавы, имеющие в своем составе содержание Si в пределах 11-13% называют близкими к эвтектическим. Кроме этого, они также известны как силуминовое литье. Стоит отметить, что если охлаждение сплава с содержанием Si 13% осуществляется медленно, то первично выделяющийся твердый раствор Si образует крупные, угловатые, игольчатые кристаллы, что, в свою очередь, чревато ярко выраженной хрупкостью подобных сплавов. Одним словом, такая структура является крайне неблагоприятной. Для того, чтобы подобного не происходило, применяют облагораживание металлов – т.е. добавляют в плавку 0,1% Na. При этом происходит очищение кристаллов кремния, а также их округление и, в конечном итоге, образование тонкодиспергированной эвтектики. Благодаря подмешиванию в сплав натрия происходит снижение эвтектической температуры до 5640С.
Если же сплав охлаждается за относительно короткий промежуток времени, что происходит в кокильном литье, то происходит действие, подобное облагораживанию металлов – сдвиг эвтектической точки при помощи переохлаждения. В результате происходит образование достаточно чистой эвтектической структуры, что избавляет от необходимости облагораживания металлов путем добавления в них натрия.
Деформируемые сплавы имеют в своем составе значительно меньшее количество легирующих элементов и примесей, в отличие от литейных сплавов. Деформируемые сплавы, обычно, отвечают более высоким требованиям. В связи с этим, для их выплавки применяется металлургический алюминий. К нестареющим деформированным сплавам относятся AlMg-сплавы. Они отличаются своей высокой твердостью и прочностью по причине легирования. Данные свойства сохраняются даже при отжиге и сварке.
К высокопрочным сплавам нового поколения относятся Al-Li- сплавы.
Титан
Представляет собой легкий тугоплавкий металл с характерным серебристо-белым цветом. Отличается своей высокой устойчивостью к коррозии. Данным свойством он обязан стабильному пассивированному оксидному слою, который образуется за достаточно короткий промежуток времени при слабых средствах окисления.

Для титановых сплавов характерна высокая жаропрочность, которая может достигать 1200 – 1400Н/мм2. Именно титановые сплавы занимают ячейку между алюминиевыми сплавами и жаропрочными сталями, поскольку могут применятся до температуры 5000С, а также до 10000С при непродолжительном использовании.
Титановый сплав используется для изготовления деталей, которые подвергаются сильной нагрузке, с целью их облегчения. Например, шатуны для высокомощных двигателей изготавливаются именно из титановых сплавов. Это связано с тем, что данный материал обладает идеальным соотношением прочности на разрыв к плотности Rm/p.
Однако, для титановых сплавов характерна достаточно высокая стоимость, что препятствует их широкому применению, в отличие от Al-сплавов.
Титану, как и железу, присуще аллотропное превращение. Титан сохраняет свою гексагональную структуру до температуры 8820С.
Среди наиболее важных легирующих элементов, которыми обогащаются технические титановые сплавы, следует назвать ванадий, олово, молибден, цирконий, ниобий, а также хром и алюминий.
Легкие металлы – перечень, свойства и польза элементов
В настоящее время такое понятие, как «легкие металлы», отсутствует в номенклатуре ИЮПАК. Таковыми принято называть металлы, имеющие небольшую плотность (как правило до 4,5 г/см3) или вес. Стоит отметить, что в настоящее время существуют такие металлы, которые легко держатся на воде, а некоторые из них имеют вес, в разы меньший пенопласта, но при этом все равно остаются достаточно прочными.

Группа легких металлов, как правило, включает в себя следующие: алюминий, олово, магний, титан, бериллий и литий. Кроме этого, к данной группе металлов часто также добавляют галлий, индий, таллий, висмут и кадмий.
Наиболее важными металлами данной группы с точки зрения технического применения являются алюминий, магний, титан, бериллий. Именно данные металлы служат в качестве основы сплавов. Алюминиевые сплавы являются наиболее значимой и распространенной группой, однако, не смотря на это, для специфического применения также предлагаются и материалы из титана и бериллия.
Что представляют собой
В номенклатуре IUPAC – уважаемой в мире международной организации, курирующей теорию и практику в сфере химии, термин «легкие металлы» отсутствует.
Читайте также: В чем разница между алюминиевыми и медными материалами в электроустановках?
Неофициально к легким металлам относятся вещества с плотностью менее 5 граммов на кубический сантиметр.
Разные списки включают пять – десять позиций.
Самое распространенное деление – по используемости:
- На этом основании выделяют пять главных: алюминий, бериллий, магний, титан, литий.
- Их дополняет «экзотика»: галлий, индий, висмут, таллий, кадмий.
Вторая группа причисляется к редким металлам.
Редкими эти элементы названы потому, что на практике используются недавно и не так широко, как традиционные материалы.
Где используют самые легкие металлы
Используют легчайшие металлы и их сплавы в разных производственных отраслях и во многих проектах. Особенно конструкции из легких металлов востребованы в:
- строительстве;
- медицине;
- металлургии;
- текстильной промышленности;
- фармацевтике;
- ядерной энергетике;
- автомобильной и аэрокосмической промышленности.
Сейчас продолжаются исследования по разработке искусственных легчайших металлов, как микролаттис. Вполне вероятно, что в ближайшем будущем появится уникальный по прочности и легкости материал, который превзойдет все известные металлы щелочной группы.
Интересует лазерная резка любых металлов и не только? Обращайтесь в компанию Мос-Лазер!
Классификация
Каждый представитель «легкой» группы относится еще к какому-нибудь сообществу.
Основанием становится не плотность, а другие физико-химические характеристики:
- Щелочные элементы – литий.
- Щелочноземельные – бериллий, магний.
- Цветные металлы – алюминий, титан, магний.
- Легкоплавкие – висмут, галлий, кадмий, таллий, индий.
- Тугоплавкие – титан, магний.
Каждый химический элемент наделен специфическими свойствами, присущими своей группе.
Нахождение в природе и значение
Самый легкий металл имеет около 30 собственных минералов, но только 5 из них используются в промышленности: пенталит, амблигонит, лепидолит, циннвальдит и сподумен. Кроме того, находится он в солёных озёрах. Всего в земной коре содержится 0,005 % этого металла.

Большие промышленные запасы лития находятся на всех континентах. Его добывают в Бразилии, Австралии, ЮАР, Канаде, США и других странах. После чего применяют его в электронике, металлургии, лазерных материалах, ядерной энергетике и даже медицине.
Большое содержание лития есть в гумусах, что говорит о его участии в круговороте природных веществ. Металл присутствует в организме животных, а также во многих растениях. Литием богаты персики, грибы, редис, картофель, морковь.
Читайте также: Технология сварки латуни с использованием аргона, видео
В нашем организме он содержится в печени, крови, лёгких, костях и других органов. Недостаток лития приводит к нарушениям в работе нервной системы и мозга. Он повышает устойчивость организма к болезням, активизирует деятельность ферментов. С помощью него борются с болезнью Альцгеймера, психическими расстройствами, склерозом, а также различными зависимостями.
Как представлены в природе
На легкий металлический сегмент приходится пятая часть литосферы (по массе).
Чаще они входят в состав руды либо минерала. Особенно химически сверхактивные элементы, например, литий. Этот самый легкий металл в природе представлен собственными минералами – лепидолитовой слюдой и сподуменом.

Сподумен
ТОП-5 легких металлов:
- Самый легкий металл — литий. Это щелочной металл имеет серебристо-белый цвет, у него наименьшая атомная масса и наименьшая плотность, которая в два раза меньше, чем у воды, — 0, 534 г/см3. Литий мягкий и пластичный, режется ножом, находится на третьем месте периодической таблицы после водорода и гелия, у металла более 30 собственных минералов. Температура плавления — +180, 54 градуса. В природе есть два стабильных изотопа лития. Металл всплывает в воде и керосине. Литий редко используется в чистом виде, так как это очень активный элемент, который быстро вступает в реакцию с окружающей средой. К тому же, литий сильно токсичен, поэтому для бытового применения не подходит.
- К числу самых легких элементов на планете относится водород — это плотность составляет 0, 0763 г/см3, но так как он не встречается в чистом виде, а только как часть молекулярных соединений, то его не причисляют к категории металлов.
- Далее следует калий, после него — алюминий, рубидий, цезий и стронций, магний, титан и другие щелочные металлы. По плотности калий уступает воде — 0, 862 г/см3. У остальных металлов плотность выше, чем у воды. Как и литий, калий вступает в реакцию с водой, поэтому чаще используется в сплавах, а не в чистом виде.
- На третьем почетном месте находится алюминий — в земной коре этот элемент достаточно распространен. Алюминий отлично проводит электричество и тепло, не подвержен коррозии, но легко подвергается сгибанию. Сплавы с алюминием пластичны, достаточно прочные, не ржавеют, хорошо свариваются и поддаются резке. Если говорить о самых прочных металлах среди самых легких, то алюминий может занять здесь первое место. Когда люди еще не умели получать этот металл промышленным путем, его цена была выше, чем на золото. Используется алюминий в ракетостроении, военной промышленности.
- Титан — химический элемент серебристого цвета с плотностью 4, 5 г/см3. Титан получил статус самого твердого металла, характеризуется высокой антикоррозийной стойкостью, сохраняет исходные характеристики даже при температуре +300 градусов.
Способы получения
Технологию выплавки легких металлов отработали к середине 19 века.
Для их получения в металлургии используется три способа:
- Электролиз расплава солей. То есть аккумуляция на электродах компонентов растворенных либо других веществ. Реакцию запускает электрический ток, пропускаемый через раствор либо расплав электролита.
- Металлотермия. Восстановление из их соединений другими, более активными металлами. Процесс проходит при повышенных температурах.
- Электротермия. Материал нагревается, затем расплавляется теплом, полученным из электрического тока.
Производство легких элементов – весьма энергоемкий процесс. Поэтому металлургические комбинаты располагают поближе к источникам энергии.
В отличие от тяжелых металлов: их базовые предприятия привязывают к месторождению.
Ценностью легких, особенно цветных металлов, обусловлен второй способ получения – переработка лома.
Сплавы лития
Свойства лития повышают отдельные качества металлов, из-за чего его часто используют в сплавах. Полезной является его реакция с окислами, водородом, сульфидами. При нагревании он образует с ними нерастворимые соединения, которые легко извлечь из расплавленных металлов, очистив их от этих веществ.
Для придания сплаву стойкости к коррозии и пластичности его смешивают с магнием и алюминием. Медь в сплаве с ним становится более плотной и менее пористой, лучше проводит электричество. Самый легкий металл повышает твёрдость и пластичность свинца. При этом он повышает температуру плавления многих веществ.
Благодаря литию металл становится прочным и устойчивым к разрушениям. При этом он не утяжеляет их. Именно поэтому сплавы на его основе применяются в космической инженерии и авиации. Главным образом используются смеси с кадмием, медью, скандием и магнием.
Из этих сплавов построены корпуса самолетов и космических ракет, изготовлена кухонная посуда, садовый инвентарь и многое, многое другое.
Легкими эти металлы называются потому, что они легче железа.
Алюминий — один из самых распространенных в мире металлов: земная кора на 7-8% состоит из него. Но алюминий не встречается в природе в чистом виде. Он образует соединения с другими химическими элементами, причем такие прочные, что их очень трудно разделить на составные части. Основная алюминиевая руда боксит содержит от 40 до 60% окиси алюминия.
Читайте также: Как удалить ржавчину с металла в домашних условиях
Алюминий обладает многими полезными качествами, благодаря которым получил в XX веке широчайшее распространение. Он очень легок, примерно в три раза легче железа, меди, никеля или цинка хорошо проводит электричество и служит прекрасным теплоизолятором, потому что его блестящая поверхность хорошо отражает тепловые лучи.
Этот чудесный металл стоек к коррозии. При взаимодействии с воздухом алюминий быстро вступает в химическую реакцию с кислородом, образуя прочную, тонкую, бесцветную пленку. Она-то и служит своеобразной преградой на пути дальнейших химических реакций и тем самым предохраняет металл от коррозии.
Вот почему из алюминия делают фольгу. Но что такое фольга? Тончайшая металлическая пластина толщиной в доли миллиметра.
Чтобы раскатать такую тонкую металлическую пластину, прибегают к помощи специальных точных машин. Ведь любое отклонение в толщине фольги сразу будет заметно. Для изготовления фольги используют чистый алюминий. Но более толстую фольгу и другие предметы нашего повседневного обихода чаще всего делают из различных сплавов металлов на алюминиевой основе. Конечно же обыкновенная алюминиевая фольга есть в каждом доме. В нее упакованы конфеты, шоколад, другие пищевые продукты. В ней хозяйки запекают мясо, рыбу, птицу в духовках кухонных плит. И конечно же многие сорта мороженого тоже манят нас своей серебристой волшебной упаковкой — алюминиевой фольгой.
От чего зависит цвет «греческих огней»
Во всех странах люди обожают всякие забавы, в том числе фейерверки. Вот уже несколько тысячелетий человечество восхищается удивительными цветами огней фейерверка.
Первые фейерверки засверкали в Китае, а в европейских странах они заискрились лишь спустя сотни лет. Жители Древней Греции любили позабавиться «греческими огнями». Многие римские императоры тоже устраивали впечатляющие огненные спектакли на радость и потеху своим подданным. Правда, те древние фейерверки значительно отличались от современных. Лишь с изобретением пороха и развитием химии фейерверки стали более изысканными.
В XIX веке умение создавать фейерверки поистине превратилось в вид искусства.
Удивительные картины с изображением флагов, лодок, знаменитых баталий иногда служили лишь своеобразным фоном. Когда такие картины зажигались огнями, создавалось впечатление, что флаги колышутся, лодки плывут, а люди сражаются на поле брани.
Создаются фейерверки с помощью селитры, серы и угля Все эти вещества перетираются в порошок, и к ним в различных пропорциях добавляются различные соли. Окраска огней зависит от следующих добавок. Стронций придает огням красный цвет, барий — зеленый, натрий — желтый, медь — синий. С помощью железных наполнителей в небе рождается серебряный дождь. Так что нужно хорошо разбираться в химии, чтобы создать современный фейерверк.
Огни, светящиеся в небе, используют не только для развлечений. Военные применяют специальные сигнальные ракеты. Огнями можно осветить все поле боя или передать необходимое сообщение. Суда, попавшие в беду, тоже взывают о помощи, запуская в небо разноцветные раке ы и огни.
Что такое карьер
Разрабатывать карьер — это значит заниматься добычей, как правило, полезных ископаемых. При этом порода вынимается каменными блоками или же дробится на отдельные куски. Каменные блоки обычно используются при строительстве, например из них построены пирамиды в Египте. А отдельные небольшие куски камня, которые называются щебнем, широко применяются при дорожных работах.
Карьеры бывают разные. В одних горная порода представляет собой сплошной монолит, в других она расположена слоями, где каждый отдельно взятый слой отличается плотностью, цветом, прочностью. Попросту говоря, карьер — это громадная, вырытая в земле яма, точнее, горная выработка. Они, как правило, бывают широкими и неглубокими.
Узкие и очень глубокие горные выработки называются шахтами. О них мы будем подробнее говорить дальше.
Иногда полезные ископаемые находятся на небольшой глубине, прямо на поверхности земли. В подобных местах удобнее вырыть неглубокие котлованы: в них можно спокойно заехать на бульдозере и без особых проблем вывезти руду.
Как узнать место, где именно следует разрабатывать карьер? Сначала необходимо провести исследования, взять пробы грунта. Здесь последнее слово остается за геологами; именно они определяют, какие полезные ископаемые и в каком количестве содержатся в данном месте.
Во время исследований больших горных разработок пробы пород берутся не только с поверхности земли, но и с больших глубин. Это делается для того, чтобы исключить возможность ошибки. Контрольные буровые работы проводятся в нескольких местах. Глубокие скважины должны подтвердить выводы ученых. Для этого применяют буры — специальные сверла диаметром 5-6 сантиметров. Они способны проникнуть сквозь плотную толщу горных пород.
Полученную породу поднимают на поверхность, затем тщательно изучают. Только после этого делают вывод: стоит ли здесь добывать руду, любую другую горную породу, стоит ли продолжать разработку карьера.
Радиоактивные металлы
Впервые радиоактивный металл радий был открыт французским физиком Пьером Кюри (1859-1906) в 1898 году. Ученый носил пробирку со своим «открытием» в нагрудном кармане, получил роковую дозу облучения и рано умер. За свое открытие вместе с женой Марией Склодовской-Кюри (1867-1934) и ученым Антуаном Анри Беккерелем (1852-1908) Пьер Кюри получил Нобелевскую премию. Это было в 1903 году.
Итак, что такое радиоактивные металлы, к которым принадлежат уран, радий, торий и нептуний? Это такие металлы, которые обладают способностью превращаться в другие химические элементы, испуская при этом различные частицы. Ученые называют их гамма-квантами.
Невероятную силу радиоактивных элементов люди узнали после взрывов ядерных бомб в японских городах Хиросима и Нагасаки в 1945 году. За считанные минуты было убито и ранено более 200 тысяч человек.
Итальянский городок Орвието однажды облетела сенсационная весть: местные специалисты обнаружили, что внутри католического собора, который был построен в XIII-XIV веках, радиоактивность повышена в 15 раз по сравнению с естественной. «Что такое? Почему? — заволновались жители Орвието. — Куда же нам теперь ходить молиться?» «Все в тот же собор, — ответили ученые. — Ничего страшного с вами не случится, вы же находитесь в соборе не круглые сутки, а довольно короткое время, пока длится служба. Во всем же виноват мрамор, из которого построили в свое время собор. Он содержит много радиоактивных элементов: урана, тория и других…»
Уран — металл с удивительными свойствами, ключ к раскрытию тайн атомной энергии. Это естественный источник радиоактивного излучения, которое широко используется в медицине, сельском хозяйстве, промышленности.
Внешне слитки чистого урана очень напоминают слитки серебра или стали. Но уран очень тяжелый металл, один из самых тяжелых химических элементов в природе. Один кубический сантиметр урана весит 19 граммов.
Отличительные свойства урана таковы. Во-первых, это радиоактивный металл, а значит, в нем постоянно протекают определенные структурные изменения, сопровождающиеся выделением энергии в виде радиоактивного излучения. Некоторые атомы урана подвержены процессу распада, то есть атомы могут расщепляться на две части, высвобождая огромное количество энергии. Процесс распада атомов урана лежит в основе работы ядерных электростанций, ядерного оружия.
Во-вторых, уран — химически активный элемент. Он вступает в реакцию со многими химическими элементами. Если уран соприкасается с воздухом, то на его поверхности быстро образуется черная пленка. Она состоит Из соединений урана и кислорода.
Читайте также: Микродуговое оксидирование алюминия в домашних условиях
В небольших количествах уран достаточно часто встречается в природе, но не в чистом виде. Процесс получения чистого урана из урановой руды длительный и трудоемкий. Из тонны переработанной руды получают всего лишь несколько граммов урана. Сначала урановую руду дробят, просеивают и обрабатывают различными химическими веществами, для того чтобы очистить ее от посторонних примесей. Затем руду в несколько этапов очищают до получения желтой, похожей на пластилин массы.
В одном килограмме урана потенциально заложено столько же энергии, сколько в трех миллионах килограммов угля. В ядерных реакторах в результате цепной реакции распада атомов урана выделяется огромное количество энергии, которая приводит в движение турбины — основные звенья в электрических генераторах.
Его следы есть в каждом кусочке земли
Почти как детективный сюжет описывает академик А.Е. Ферсман встречу с этим диковинным металлом. «Большое многоэтажное здание с тихими лабораториями и кабинетами. Нас ведут по лестницам в подвал, потом подземным коридором в небольшую бетонированную камеру с толстыми стенками… Гремят замки — в пустой комнате без окон стоит небольшой железный шкаф. При потушенном электричестве отворяются дверцы, и привыкший к темноте глаз видит несколько светящихся полосочек. Камень в кольце нашего провожатого начинает ярко сверкать, неожиданно вспыхивая при повороте руки и усиливая свет при приближении к полоскам. Зажигается электричество, и в наших руках оказывается одна из этих светящихся полосочек, просто малюсенькая стеклянная трубочка — в ней белый порошок. Его только два грамма — щепоточка. Но сила этой щепоточки поистине замечательна: она постоянно испускает из себя чудодейственные лучи-частицы, часть которых незаметно превращается в замечательный газ Солнца — гелий».
Что же за вещество находится в пробирках? Это соль радия, одного из радиоактивных металлов, известных человечеству. Оказывается, этой солью лечат тяжелейших раковых больных. Лучи, выделяемые белым порошком в пробирке, могут спасти от гибели ткани организма.
Только через две тысячи лет тепло, излучаемое порошком из пробирки, ослабеет наполовину. Лучи же его мчатся в одних случаях со скоростью света, в других — со скоростью 20 000 км/с.
Прежде чем превратиться в белый порошок, радий проходит долгую историю сначала в недрах Земли, потом на заводах и в промышленных лабораториях.
Нет такого кусочка земли, где бы не было ничтожнейших следов этого металла. В любой породе можно отыскать 0,000000001% этого редкого металла, то есть в 10 000 раз меньше, чем золота или серебра. Ученые подсчитали, что в поверхностном слое земли до десяти километров в глубину содержится около одного миллиона тонн радия.
Радий, рассеянный в земле, недоступен человеку. Но иногда сама природа приходит на помощь: в некоторых местах она накапливает этот металл, правда до известных пределов. Больше чем в сотых долях миллиграмма на сто граммов породы радий никогда не встречается, и наука утверждает, что большее содержание невозможно. Но на самом деле руды гораздо беднее. В одном вагоне руды содержится всего лишь один грамм соли радия. Вот из-за такой-то малости человек и научился перерабатывать тонны и тонны руды.
Токсичность
Несмотря на важную биологическую роль лития в нашем организме, он может быть опасным. Самый легкий металл достаточно токсичен и способен вызывать отравления. При горении он провоцирует раздражение и отёки слизистых оболочек. Если на них попадет кусочек целого металла, произойдёт то же самое.

Литий нельзя брать в руки без перчаток. Взаимодействуя с влагой в воздухе или влагой на коже, он легко вызывает ожог. С расплавленным металлом нужно быть ещё осторожнее, так как его активность повышается в разы. При работе с ним нужно помнить, что это щелочь. Уменьшить его действие на кожу можно обычным уксусом.
В организме литий повышает устойчивость иммунной системы и улучшает работу нервной системы. Но его переизбыток сопровождается головокружением, сонливостью, потерей аппетита. Отравление металлом приводит к снижению либидо, слабости в мышцах, набору веса. При этом может ухудшиться зрение, память и наступить кома. Работать с литием нужно всегда в перчатках, защитном костюме и очках.
Цветные металлы
Цветные металлы стоят дороже черных, потому что более востребованы в мире. Они нужны при изготовлении автомобилей, строительстве домов и в области высоких технологий — именно они являются основными материалами при изготовлении смартфонов и другой электроники. В сфере строительства они нужны для изготовления всевозможных арматур, балок, уголков и так далее.

Железо и его сплавы относятся к черным металлам, а все остальное — это цветные металлы
Цветные металлы принято разделять на три группы:
Тяжелые металлы
Самыми яркими представителями этой категории цветных металлов считаются медь, латунь и бронза. Наибольшим спросом среди них пользуется медь, потому что она — отличный проводник электрического тока и широко применяется в электронике. Из латуни изготавливают различные проволоки, подшипники и другие металлические элементы. Из бронзы нередко делают памятники, потому что она не боится дождя, снега и механических повреждений.

Несколько лет назад ученые выяснили, что медь способна предотвратить распространение вирусов
Легкие металлы
Самые популярные легкие металлы, это алюминий, магний и титан. Их довольно легко расплавить, а также они легче черных металлов. Благодаря устойчивости к коррозии, высокой пластичности и небольшой массе, алюминий активно используется в строительстве самолетов и автомобилей. Магний широко применяется в изготовлении корпусов для различной техники, начиная с фотоаппаратов и заканчивая двигателями. Титан отличается высокой прочностью и небольшой массой, поэтому применяется при изготовлении космических ракет.

В воздухе алюминий мгновенно покрывается пленкой, которая защищает ее от возникновения ржавчины
Благородные металлы
К благородным металлам относятся золото, серебро и платина. Из-за сложности добычи и своей красоты, они считаются самыми дорогими разновидностями металлов. Их стоимость постоянно меняется и их можно купить в банках, тем самым вложив в них свои деньги. Также благородные металлы широко используются в ювелирном деле. Из них изготавливаются кольца, браслеты и прочие украшения.

Про алюминий можно почитать в материале про самые ценные металлы в мире
Какой цвет у металла?
Железо, свинец и мышьяк – сероватый. В сильно измененном состоянии металлы имеют серый, коричневый или черный цвет. При пребывании в течении длительного времени на воздухе большинство металлов окисляется и темнеет.
Какие последовательности существуют? Какие последствия после процедуры банкротства физ лиц? Какие последствия признания брака недействительным? Какие правила безопасности нужно соблюдать находясь у водохранилища? Какие правила надо соблюдать в общественном транспорте? Какие предельно допустимые концентрации вредных веществ бывают? Какие предметы надо знать чтобы стать нотариусом? Какие предметы нужно сдавать для поступления на пилота? Какие предметы нужно сдавать на психотерапевта в Украине? Какие предметы нужно сдавать в 9 классе что бы выучиться на парикмахера?
Металлы. Их разновидности и свойства

Металлы , на сегодняшний день, являются одними из самых широко используемых материалов в мире. Металлами называют соединения с закономерным расположением атомов в узлах пространственной кристаллической решётки, которая обладает характерным блеском, способностью проводить тепло и электрический ток, а также отражать световые лучи. Для металлов характерны такие свойства как плотность, прочность, выносливость, свариваемость, пластичность, электропроводность, возможность создания различных сплавов.
Наличие данных свойств и характеризует, так называемое, металлическое состояние вещества. Такими свойствами обладают 75% всех элементов в периодической системе Менделеева. Неметаллы же не обладают вышеперечисленными свойствами и значительно отличаются по структуре, физическим и химическим свойствам от металлов.
Можно сказать, что металлы являются отличными проводниками электрического тока. Их свойства полностью диктует их кристаллическое строение и атомарный состав. Вследствие воздействия высокой температуры металлы частично снижают показатель своей электропроводности. В условиях же низкотемпературного режима электропроводность определенных видов металла возрастает, поэтому такие виды считаются сверхпроводниками. Дело в том, что в атомах металлов, прочно связанных в кристаллическую решетку, электроны могут легко передвигаться по всему объему, а не только на внешних слоях атома.

Сплавы — это вещества, состоящие из двух и более металлов, которые получаются с помощью плавления простых элементов. По числу компонентов сплавы делятся на двухкомпонентные (двойные), трехкомпонентные (тройные) и многокомпонентные. Компонент, который содержится в сплаве больше всего, называется основным, а компонент, вводимый в сплав для наделения ему нужных свойств – легирующим. В целом, совокупность компонентов сплава можно назвать системой. Изменяя компоненты и их пропорции, получают множество всевозможных сплавов с разнообразными физическими, механическими или химическими свойствами. Сплавы тоже располагают всеми характерными свойствами металлов, однако качественные характеристики их обычно заметно отличаются от самородков. Так, например, сплав, содержащий 40% кадмия и 60% висмута, имеет температуру плавления 144ºС, а температура плавления составляющих его компонентов – соответственно 321ºС и 271ºС, т. е. намного выше. Огромное преимущество сплавов заключается в том, что они превосходят чистые металлы по прочности, твердости, износостойкости и жаропрочности. Поэтому сплавы применяются значительно шире чистых металлов.
Классификация металлов и сплавов
Отличие металлов от сплавов заключается в различных визуальных признаках, такие как зернистость и гладкость поверхности. Также сплавы обладают теплопроводностью и электропроводностью.
Наиболее широкое распространение в промышленности получили медные, титановые, бронзовые и алюминиевые сплавы. Данные элементы служат сырьем для производства различных деталей и выливания металлоконструкций.
Классифицировать образцы металлов можно и более детально, взяв во внимание их целевое применение, сферы использования и принципы работы.
Существует также классификация металлов в соответствии с ГОСТом.
Каждый из стандартов определяет требования к металлическим материалам, к их индивидуальным характеристикам и сферам использования. Данные критерии становятся основными при выборе материала для определенной цели.

Дерево классификаций металлов
Группы металлов
Все металлы можно разделить на две группы, которые не только их имеют схожесть по свойствам, но и по промышленному применению. Такими группами являются черные и цветные металлы.
Черные металлы получили свое название из-за цвета, который меняется от темно-серого практически до белого. Они обладают значительной плотностью, высокой температурой плавления и твердостью. Самым распространенным и наиболее часто применяемым в промышленности представителем черных металлов является железо.
Цветные металлы также названы благодаря цвету простых веществ. Их цвет может быть красным, желтым, белым. Цветным металлам свойственны также уникальные физические и химические свойства. Они пластичны, мягки и легкоплавки по сравнению с черными металлами.

Класс черных металлов включает два подвида – сталь и чугун. Стали могут быть углеродистыми или легированными.
Различные виды черных сплавов получили значительное распространение в области изготовления металлопроката. Они обладают отличными рабочими свойствами, поэтому на рынке черные металлы всегда востребованы.
Добыча материалов происходит из железной руды, а с помощью доменной печи, где при температуре около 2000 градусов протекает процесс плавка руды, получают железо. По сути, способов выработки железа множество. Также помимо доменного процесса получения железа, существует способ прямого получения железа из предварительно измельченной железной руды с добавлением специальной глины. При этом способе железо получается в твердом виде, которое впоследствии переплавляется в мощных электрических печах.
Кроме видов металлов и их сплавов, существуют также и различные марки, разновидность которых указывается в буквенно-цифровом виде, например Ст3. Группировка марок черного металла используемая в металлопрокате, значительно облегчает поиск того или иного вида черного металла для различных сфер жизнедеятельности человека.
Любой металлопрокат по форме, размерам и предельным отклонениям должен строго соответствовать требованиям ГОСТ. К черному металлу относятся следующие виды проката: листовой, сортовый, фасонный, трубный. Как уже известно, к черным металлам относится чугун и сталь, которые, по сути, очень схожи за исключением количества содержащегося углерода.
Чугуны — сплавы содержащие углерод более 2,14 % (в некоторых чугунах до 6 %).
Стали — сплавы железа с углеродом при содержании углерода менее 2,14 %. Стали также бывают низкоуглеродистые (содержание углерода менее 0,25%), углеродистые (0,25 — 0,6 %), высокоуглеродистые (более 0,6 %). Низкоуглеродистые стали легко свариваемы и весьма пластичны, высокоуглеродистые же напротив – очень твердые, благодаря чему применяются в агрегатах режущих инструментов.
Кроме углерода в чугунах и сталях содержатся другие компоненты, такие как кремний, марганец, сера, фосфор.

Свое название данная группа металлов и сплавов получила, благодаря своим цветовым характеристикам. Например, медь – красного цвета, и ее сплавы имеют красноватый оттенок.
Сплавы получаются в результате смешивания металлов в различных пропорциях., от чего появляется новый продукт, обладающий улучшенными свойствами, чем исходный металл. Цветные металлы классифицируют последующим категориям.
Сплавы цветных металлов, в их различных и определенных пропорциях, помогают добиться тех или иных свойств, благодаря которым становится возможным их применение в массовом производстве изделий. Механические, физические и химические свойства сплавов можно менять не только при помощи изменений пропорций исходных металлов, но и путем дополнительного механического или химического воздействия на них, например, термообработкой, применения технологий старения и т.д. К механической обработке цветных металлов относится штамповка, ковка, прессование, прокатка, пайка, сварка и резка.
Тяжелым цветные металлы : свинец, медь, олово, цинк, никель, ртуть.
Легкие цветные металлы : алюминий, титан, магний, бериллий, стронций, кальций, литий, барий, калий, натрий, цезий и рубидий.
Благородные цветные металлы : платина, золото, серебро, осмий, родий, рутений, палладий.
Тугоплавкие цветные металлы: вольфрам и ванадий, молибден и тантал, хром и ниобий, цирконий и марганец.
Рассеянные цветные металлы: индий, таллий, германий, рений, селен, гафний и теллур.
Радиоактивные цветные металлы: уран, торий, радий, нептуний, актиний, америций, протактиний, плутоний, эйнштейний, калифорний, фермий, нобелий, менделевий и лоуренсий.
Многочисленную группу составляют редкоземельные металлы, такие как: тулий, эрбий, прометий, лютеций, церий, лантан, неодим, празеодим, европий, самарий, тербий, гадолиний, иттербий, гольмий, диспрозий,, иттрий и скандий.
Стоит отметить, что большая часть литых изделий, а также проволока, квадраты, шестиугольники в виде прутков и мотков, ленты и полосы, листы и фольга изготавливаются из цветных металлов. В последнее время в производстве даже начали использоваться порошки из данных металлов.
Внутреннее строение металлов

Поскольку металлы в твердом состоянии имеют кристаллическое внутреннее строение, то образующие их элементарные частицы (атомы) в процессе кристаллизации из расплавленного состояния группируются в строго определенной последовательности. Эта последовательность называется кристаллической решеткой, представляющая собой воображаемый элемент объёма, который образован минимальным количеством атомов, чье многократное повторение позволяет построить весь кристалл.
Всего существует 14 различных типов кристаллических решёток. Металлы преимущественно кристаллизуются в одном из трёх типов структур: объёмноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ). Для изображения кристаллической решётки пользуются упрощенными схемами. В объёмно-центрированной кубической решётке содержится девять атомов: восемь расположены в вершинах куба и один – в центре объёма. Такую решётку имеют молибден, вольфрам, ванадий и другие металлы.

Физико-механические свойства металлов и сплавов
Определение и классификация железа
Железо — это название химического элемента, который условно называют низкоуглеродистой сталью или чистое железо. Под чистым железом понимается тяжелый металл серебристо-белого цвета, который содержит не более 0,6% примесей, в том числе углерода ≤0,04% от общего объёма. Эталонное железо, которое может быть получено на сегодняшний день, содержит 99,999% молекул чистого железа, то есть химического элемента Fe . Техническое железо содержит 0,1…0,2% примесей. Следует также отметить, что технически чистое железо имеет невысокие физико-механические характеристики, например твёрдость. Чистого железа в природе практически не встречается, за исключением метеоритов. Это объясняется способностью железа свободно соединяться с другими элементами, особенно с кислородом.

В природе железо чаще всего встречается в составе железных руд в виде оксидов (Fe3O4; Fe2О3; 2Fe2O3*3H2O) и других соединений. После извлечения железа из руд оно содержит в своем составе определенное количество углерода и небольшое количество примесей. Соединение железа с углеродом называется – железоуглеродистый сплав. Сплавы, которые содержат углерод в количестве 0…0,02%, называются техническим железом, 0,02…2,14% – сталями, 2,14…6,67% – чугунами. Свойства железоуглеродистых сплавов, их назначение и способы обработки определяются количеством углерода. Углерод придает сплавам железа прочность и твердость, однако при этом снижает пластичность и вязкость.
Чугун
Чугун является прочным металлическим материалом, который получил свое широкое распространение практически в любой области. Прежде всего, следует рассмотреть производство чугуна. Получение чугуна заключается в восстановлении железа из оксидов железной руды. Производство чугуна ведется преимущественно в доменных печах. Чугун является первичным продуктом переработки железных руд.
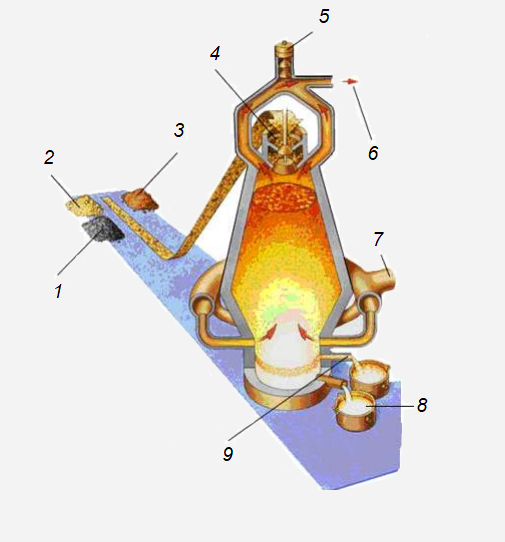
Схема работы доменной печи:
1 – кокс;
2 – известняк;
3 – железная руда;
4 – поступление сырья;
5 – предохранительный клапан;
6 – выход отходящих газов;
7 – поддув горячего воздуха;
8 – чугун;
9 – шлак.
Для производства обычного доменного чугуна используют шихту, которая состоит из железной руды, флюса, окатышей и топлива. В состав железной руды входят железосодержащие минералы и пустая порода. Пригодность железной руды для доменной плавки определяется содержанием железа, составом пустой породы и концентрацией вредных примесей. В зависимости от концентрации железосодержащих минералов железные руды бывают богатыми, которые непосредственно используют, и бедными, которые подвергают обогащению.
Для доменного чугуна в качестве железных руд используются магнитные железняки (магнетит), красные железняки (гематит), бурые железняки (гетит) и шпатовые железняки (сидерит), содержащие около 30…70% железа в виде оксидов Fe2O3 или Fe3O4. В состав пустой породы входят оксиды кремния SiO2 (кремнезём), алюминия Аl2O3 (глинозём), кальция СаО, магния МgO и другие составляющие.
Флюсы предназначены для понижения температуры плавления, обеспечения плавки руды и связывания пустой породы, неизбежно остающейся в руде после процесса рудоподготовки. По химическому составу различают основные флюсы, кислые и нейтральные. К Основным флюсам относится известняк и доломит, к кислым – кремнезём, к нейтральным – глинозём. Они сплавляются с пустой породой и золой топлива, которые вместе образуют легкоплавкий сплав, не смешивающийся с жидким чугуном.
Основным видом топлива в доменном процессе служит кокс и природный газ или пылевидный каменный уголь. Топливо при выплавке чугуна является не только источником тепла, но и принимает участие в окислительно-восстановительных реакциях, протекающих в процессе плавки. Оно является также и основным источником углерода.

Доменная печь, или как ее еще называют – домна, относится к разряду шахтных и работает по принципу противотока. Внутри печь выложена огнеупорным материалом (чаще всего используют для этого шамотный кирпич), сверху покрыта стальным кожухом. Современные доменные печи имеют общую высоту до 80 метров и объём рабочего пространства до 5600 м 3 , что соответствует 12000 т готового чугуна в сутки.
На сегодняшний день технологический процесс производства чугуна полностью автоматизирован. Шихта непрерывно подается через загрузочные конвейеры в верхнюю часть печи, а снизу через фурмы вдувается горячий воздух. В условиях доменной печи при температуре 1900°С происходит интенсивное насыщение железа углеродом, поэтому доменный чугун обычно содержит от 2,14 до 4,6% углерода, около 93% железа и небольшое содержание примесей кремния (0,5…4%), марганца (1…3%), фосфора (0,02…2,5%), серы (0,005…0,08%) и др., перешедших в чугун из пустой породы. Углерод в чугуне содержится в виде цементита или графита.
Флюсы взаимодействуют с компонентами руды, образуя при этом шлак, который состоит из вредных примесей (сера, фосфор), пустой породы, излишек марганца и некоторых цветных металлов. Доменные газы выпускаются через верхнюю часть печи. Расплавленный чугун стекает вниз, а расплавленный шлак, как более легкая смесь, находится сверху чугуна, предохраняя его от окисления. Жидкий чугун выпускается через нижнюю летку, шлаки – через верхнюю.
В доменных печах получают жидкий передельный и литейный чугуны, доменные ферросплавы, шлак и доменные газы. Чугун является основным и главным продуктом доменного производства, а шлак и доменные газы – побочными. По форме включения графита в сплаве различают:
· серый чугун с пластинчатым графитом (СЧ);
· чугун с вермикулярным (червеобразным) графитом (ЧВГ);
· высокопрочный чугун с шаровидным графитом (ВЧ);
· ковкий чугун с хлопьевидным графитом (КЧ).
В зависимости от химического состава выпускаются нелегированные и легированные чугуны. Легированные чугуны это сплавы для специального назначения, который используется приблизительно тот же комплекс легирующих элементов, что и в сталях: хром, никель, алюминий, молибден и ванадий.
Разновидности чугуна
В зависимости от химического состава и микроструктуры выпускают передельный, литейный, белый, серый, модифицированный, высокопрочный и ковкий чугуны. Разберем по отдельности каждый вид чугуна и выявим их уникальные особенности.
Передельный чугун . Данный вид чугуна содержит 4…4,5% углерода, 0,6…0,8% кремния, 0,25…1,0% марганца, до 0,07% серы и до 0,3% фосфора. В его структуре преобладает цементит, который является твердым и в то же время хрупким соединением. Передельный чугун выпускается трех типов:
· для сталеплавильного (марки П1 и П2) и литейного (ПЛ1 и ПЛ2) производства;
· фосфористый (ПФ1, ПФ2 и ПФ3);
· высококачественный (ПВК1, ПВК2 и ПВК3). На долю передельного чугуна приходится до 90% всей продукции доменных печей.
Нормативы передельного чугуна регламентируются межгосударственным стандартом ГОСТ 805-95.

Литейный чугун . Литейный чугун отличается от передельного повышенным содержанием кремния (до 3,6%) и в некоторых марках фосфора (до 1,2%). В зависимости от массовой доли кремния и назначения чугуна, изготовляют различные марки от Л1 до Л6. Также возможно изготовление чугуна с применением литейного рафинированного магния марок, благодаря чему получаются марки от ЛР1 до ЛР7. Предназначается литейный чугун для дальнейшей переплавки в чугунолитейных цехах при производстве чугунных отливок. Нормативы литейного чугуна регламентируются межгосударственным стандартом ГОСТ 4832-95.
Белый чугун. По сути белый чугун по структуре схож с серым за разницей лишь того, что для каждого вид существуют различные условия охлаждения. Белый чугун получают при быстром охлаждении расплава. По сути это передельные чугуны, в которых весь углерод находится в связанном состоянии в виде цементита. В поперечном сечении они имеют матово-белый цвет и характерный металлический блеск. Из-за большого содержания цементита белые чугуны обладают высокой твёрдостью (450…550 НВ), износостойкостью, хрупкостью, но плохо обрабатывается. Поэтому для изготовления изделий они не используется. Применяются как передельный чугун для производства стали или для отливки деталей с последующим отжигом на ковкий чугун.
Серый чугун. Так называются литейные чугуны с пластинчатой формой графита, в изломе имеющие серый цвет. Содержание углерода в связанном состоянии составляет не более 0,5%. Его получают при медленном охлаждении жидкого чугуна. Механические свойства серого чугуна определяются в основном количеством, формой и размерами графитных структур. По сравнению с металлической основой они имеет более низкую прочность, так как графитные соединения нарушают сплошною структуру материала, что ослабевает металлическую основу. Чем меньше графитовых включений и выше их дисперсность, тем больше прочность чугуна. В случае предварительного подогрева может хорошо свариваться, обладает хорошими литейными свойствами. Выпускается марок СЧ-10…СЧ-35.
В основу стандартизации серого чугуна положен принцип регламентирования минимально допустимого значения временного сопротивления разрыву при растяжении. Например, марка СЧ-15 указывает, что минимальное временное сопротивление при растяжении серого чугуна составляет не менее 150 МПа. В строительстве серый чугун применяют главным образом для изготовления изделий, работающих при сжатии (башмаки, тюбинги, колонны в санитарно-технических системах) и в архитектурно-художественном оформлении.
Высокопрочный чугун. Данный тип чугуна является разновидностью серого, но из-за повышенных механических свойств они состоят в особой группе. Получают при модифицировании жидкого серого чугуна магнием или церием (0,03…0,07% от массы отливки). В результате модифицирования частицы графита находятся в чугуне в виде маленьких сфер, которые исключают образование и распространение трещин. Помимо высокой прочности чугун обладает также высокой пластичностью, что делает его уникальным.
Условное обозначение марки высокопрочного чугуна включает буквы ВЧ – высокопрочный чугун и цифровое обозначение величин предела прочности при растяжении (МПа) и в ряде случаев относительного удлинения (%). Выпускается марок ВЧ-35…ВЧ-100. Например, марка ВЧ 100-2 указывает, что предел прочности при растяжении высокопрочного чугуна составляет 1000 МПа при относительном удлинении 2%.
Высокопрочные чугуны используются в различных отраслях техники, эффективно заменяя при этом сталь во многих изделиях и конструкциях. Из них изготовляют разнообразные профильные трубы, оборудования прокатных станов, кузнечно-прессовые оборудования, корпуса паровых турбин, коленчатые валы и другие детали, работающие при циклических нагрузках и в условиях сильного износа. Нормативы высокопрочного чугуна регламентируются межгосударственным стандартом ГОСТ 7293, EN 1563.
Общие сведения о сталях
Сталь — это деформируемый сплав железа с добавлением углерода и другими обязательными примесями, такие как кремний, сера, фосфор. Сталь занимает левую часть диаграммы состояния железоуглеродистых сплавов (см. изображение выше).
Доля железа ( Fe ) в сплаве составляет около 90…98,5%, а доля углерода не превышает 2,14%. Также в состав стали входят и другие химические элементы, вводимые специально для улучшения показателей свойств или легирования. В этот состав входят такие компоненты как кремний, марганец, фосфор, сера, никель, ванадий, хром и молибден. По сравнению с чугуном сталь имеет лучшие механические свойства, что обусловлено, прежде всего, меньшей концентрацией углерода.
Производство стали и изготовление из нее изделий представляет собой сложный процесс, сочетающий химические и технологические процессы, целый перечень специализированных операций, которые используются для получения качественного металла и различных изделий из него. Исходным сырьем для производства стали являются ферросплавы, металлодобавки, флюсы, окислители, металлошихта, среди которых может быть передельный чугун или стальной лом. Чугун переделывается в сталь в мартеновых или дуговых электросталеплавильных печах.
Если сравнить содержание основных примесей в стали и чугуне, то в стали их на порядок меньше. Следовательно, целью любого металлургического передела чугуна в сталь является снижение содержания углерода и примесей путем их выгорания и перевода в шлак и газы в процессе плавки с последующим раскислением. В результате получается сталь заданного химического состава.
Конвертерный способ производства стали, включающий несколько разновидностей, заключается в том, что залитый в плавильный агрегат жидкий чугун, нагретый до температуры 1250…1400℃, вместе с другими компонентами, включающие в себя металлоломом и шлакообразующие вещества, продувают кислородом через водоохлаждаемую фурму. Кислород воздуха окисляет примеси чугуна, в результате чего происходит повышение температуры до 1600℃ и чугун превращается в сталь. При этом образуется химически активный шлак с необходимым содержанием оксида кальция для удаления примесей. Следовательно, источником теплоты при конвертерном способе являются химические реакции окисления элементов, входящих в состав чугуна. Последними операциями плавки являются слив металла, а затем шлака.
Мартеновский процесс перевлапвки чугуна в сталь осуществляется в плазменной отражательной печи, оснащенной системой регенерации, которая направлена на использование теплоты отходящих при горении газов для подогрева воздуха и газообразного топлива. Металлическая часть шихты для ведения плавки состоит из чугуна и стального лома, доля каждого из которых, может изменяться в процентном соотношении от 0 до 100%. Сталь получается в результате окислительной плавки загруженных в печь железосодержащих материалов и сложных процессов взаимодействия между металлом, шлаком и газовой средой.
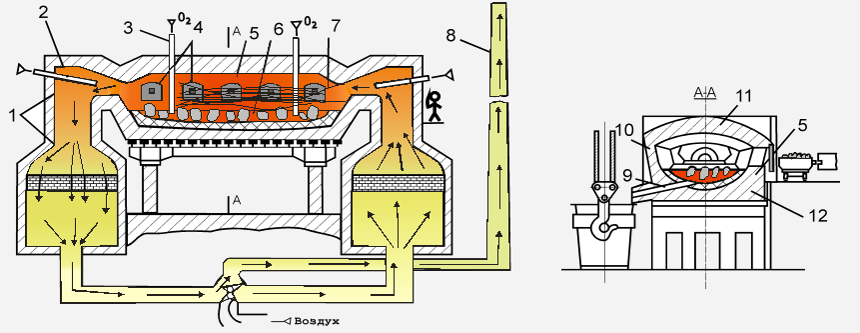
Схема получения стали из мартеновской печи:
1 — регенератор; 2 — головка печи (служит для смешивания топлива с воздухом); 3 — трубка с кислородом
4 — загрузочное окно; 5 — передняя стенка; 6 — шихта; 7 — факел; 8 — дымовая труба; 9 — желоб для выпуска
стали; 10 — задняя стенка; 11 — свод печи; 12 — подина
Выплавка стали в электропечах основана на использовании электроэнергии для нагрева металла. Электрические печи для плавки металла подразделяются на дуговые, индукционные и печи сопротивления. Источником тепла в дуговой печи является электрическая дуга, которая возникают между электродами и жидким металлом или шихтой при приложении к электродам электрического тока необходимой силы. Дуга представляет собой поток электронов, ионизированных газов и паров металла и шлака с температурой, превышающей 3000℃. В индукционных печах для выплавки стали используется тепло, выделяющееся за счет влияния электрического тока переменным магнитным полем. Проводящая электрический ток шихта подвергается воздействию переменного магнитного поля и нагревается вследствие теплового воздействия вихревых токов. Индукционные печи применяют для выплавки высоколегированных сталей и сплавов с низким содержанием углерода, а также для производства тонкостенного фасонного литья.

Выплавка стали в электропечах
Полученную в сталеплавильных агрегатах сталь выпускают в разливочный ковш, а затем либо разливают в металлические формы, либо направляют к машинам непрерывного литья стали. Незначительная часть стали идет на фасонное литье. В результате затвердевания металла получаются стальные слитки или заготовки, которые в дальнейшем подвергают обработке с помощью давления. Технология и организация разливки является весьма ответственным этапом в общем производстве стали и в значительной мере определяет её качество и количество отходов при последующем переделе стальных слитков.
Разновидности сталей
Металлургической промышленностью разных стран вырабатывается более 2 тысяч различных марок сталей и сплавов на основе железа. На долю углеродистых сталей приходится около 80% от общего объёма выплавки.

Углеродистая сталь. Эта сталь представляет собой сплав железа с углеродом, содержащим до 2% углерода и постоянных примесей: кремния – до 0,5%, марганца – до 2%, серы и фосфора – до 0,05%. По содержанию углерода различают низкоуглеродистые (с содержанием углерода до 0,25%), среднеуглеродистые (0,25…0,6%) и высокоуглеродистые (более 0,6%). Содержание углерода и примесей определяют дальнейшую структуру и свойства стали.
С ростом содержания углерода в структуре стали увеличивается количество цементита, при одновременном снижении доли феррита. Данное изменение приводит к повышению прочности и уменьшению пластичности. Однако прочность стали повышается до содержания углерода 0,8…1,0%, а затем с повышением содержания углерода уменьшается не только прочность, но и пластичность, так как образуется грубая сетка вторичного цементита. Увеличение содержания углерода повышает также порог хладноломкости и снижает ударную вязкость, ухудшаются литейные свойства, обрабатываемость давлением и резанием, свариваемость. Однако стали с низким содержанием углерода тоже плохо обрабатываются резанием.
В сталях всегда присутствуют примеси, подразделяющиеся на постоянные или обычные (например, кремний, марганец, сера и фосфор), скрытые (газы в виде кислорода, азота и водорода), специальные (легирующие) и случайные. Наличие примесей в стали объясняется технологической особенностью её производства и невозможностью от их полного полного удаления. Они тоже оказывают существенное влияние на качество стали.
Углеродистые конструкционные стали могут быть обыкновенного качества (по ГОСТ 380-2005) и качественными (по ГОСТ 1050-2015). Для строительных металлических конструкций применяют в основном низкоуглеродистые стали обыкновенного качества, а для важных и ответственных строительных объектов– качественные. В углеродистых сталях обыкновенного качества допускается повышенное содержание примесей, а также газонасыщенность и загрязненность неметаллическими включениями.
В зависимости от содержания углерода, марганца и кремния углеродистая сталь обыкновенного качества подразделяется на марки от Ст0 до Ст6. Буквы «Ст» обозначают «сталь», цифры – условный номер марки в зависимости от химического состава. При этом с увеличением номера содержание углерода в стали возрастает, но прямого количественного соответствия номера и содержания углерода нет. Буквы, которые стоят после номера стали, указывают: «Г» – на содержание марганца при его массовой доле в стали 0,8% и более и «кп», «пс» и «сп» – степень раскисления стали. Чем выше марка стали, тем больше в ней содержание углерода, выше прочность и, соответственно, ниже пластичность.
Качественные углеродистые стали маркируют двузначными цифрами, показывающими среднее содержание углерода в сотых долях процента (05; 08; 10; 25; 40 и др.) и буквами, указывающими на степень раскисления стали. Углеродистая сталь обыкновенного качества используется для изготовления горячекатаного проката: сортового, фасонного, толстолистового и тонколистового проката, широкополосного и холоднокатанного проката, а также слитков, блюмов, слябов, сутунки, труб, лент, проволоки, метизов и других изделий.

Легированная сталь . Легированными называют стали, в которые для получения требуемых свойств вводят специальные добавки других элементов, с соблюдением массовой доли. Чаще всего легирующими добавками являются – никель, хром, молибден, вольфрам, медь и др. Добавки оказывают различное влияние, как на кристаллическое строение, так и на физико-механические характеристики стали. Легированные стали обладают также более высоким уровнем механических и технологических свойств и прежде всего прочности. С помощью легирования можно придать стали различные специальные свойства такие как — антикоррозионную, износостойкость, жаростойкость и тд. По степени легирования (суммарное содержание легирующих элементов) различают низколегированные (менее 2%), среднелегированные (от 2 до 10%) и высоколегированные (более 10%) стали.
Низколегированные конструкционные стали являются переходными между углеродистыми и легированными. Они имеют, по сравнению с углеродистой сталью, повышенную прочность, пониженную склонность к старению, хорошую свариваемость, повышенную износостойкость и коррозионную стойкость в различных средах. В зависимости от количества легирующих элементов стали могут быть трёхкомпонентные (железо + углерод + легирующий элемент), четырёхкомпонентные (железо + углерод + 2 легирующих элемента) и т. д. По наличию основных легирующих элементов сталь подразделяется на группы: хромистая, марганцевая, хромоникелевая, хромокремнистая и др.
По назначению легированные стали подразделяются на конструкционные, инструментальные и с особыми свойствами. Легированная конструкционная сталь (ГОСТ 4543-2016) в зависимости от химического состава и свойств делятся на качественные, высококачественные (А) и особовысококачественные (Ш). По видам обработки при поставке сталь разделяют на горячекатаную, кованую, калиброванную, серебрянку.
В обозначении марок конструкционной легированной стали первые две цифры обозначают содержание углерода в сотых долях процента, а буквы обозначают легирующий элемент. Цифры после букв указывают на среднее содержание данного элемента в целых единицах. Отсутствие цифры означает, что содержание данного легирующего элемента менее 1,5%.

Строительная сталь . Стали, которые используются для изготовления металлических конструкций в сооружениях промышленного и гражданского строительства, пролётных строений мостов, магистральных нефте-газопроводов, армирования бетона называют строительными. Основные требования, предъявляемые к таким сталям – это высокие прочностные параметры (куда включен предел текучести и временное сопротивление разрыву при растяжении), хорошая свариваемость, значительная пластичность, надежность и долговечность. Нормируется также химический состав с указанием предельного содержания углерода, азота, алюминия, кальция, фосфора, серы и других элементов.
В основном для строительных целей применяют низколегированные и углеродистые стали обыкновенного качества. Низколегированные стали содержат до 0,2% углерода, 2…3% легирующих элементов и микродобавки. С увеличением содержания углерода повышается твердость, прочность, улучшается обработка резанием, но снижается пластичность и ухудшается свариваемость. Строительные стали повышенной прочности дополнительно содержат небольшое количество ванадия или ниобия, а также медь в количестве 0,15…0,3%. Благодаря меди повышается стойкость к атмосферной коррозии. Низколегированные строительные стали обладают высокой пластичностью и ударной вязкостью, имеют улучшенные механические свойства и пониженную температуру перехода в хрупкое состояние (от – 40℃ до – 60℃). Поставка строительных сталей с разделением по механическим свойствам в виде листов разной толщины и сортового проката.
Цветные металлы и сплавы

Общие сведения. Доля цветных (не железных) металлов в общем объёме мирового производства металлов составляет немногим более 5%. Объясняется это их небольшим содержанием в земной коре, малым содержанием в рудах, сложностью производства, а, следовательно, и высокой стоимостью. Однако, несмотря на более высокую стоимость и сложность производства, они находят достаточно широкое применение в изготовлении металлических конструкций, различных декоративных элементов, облицовочных панелей, дверей, оконных рам, кровельных материалов, труб и других изделий. И всё это благодаря их уникальным физико-химическим и механическим свойствам.
Цветные металлы обладают большой пластичностью, малой твёрдостью, имеют широкий диапазон температур плавления. Например, температура плавления алюминия 660℃, а тантала – 3015℃. Условно различают лёгкие цветные металлы (плотность до 5000 кг/м 3 ) и тяжёлые – плотностью более 5000 кг/м 3 . К лёгким металлам относят магний, алюминий, титан, бериллий, к тяжёлым – медь, свинец, олово, никель.
Из группы цветных металлов выделяют также легкоплавкие и тугоплавкие металлы. Четкой границы между тугоплавкими и легкоплавкими металлами нет. Условно считается порог в 500℃. К легкоплавким металлам относят олово, свинец, цинк, кадмий, висмут. Некоторые из них используют для приготовления припоев различных составов и назначения. К тугоплавким металлам относят хром, титан, молибден и др. Их используют главным образом в качестве легирующих добавок.
Применяют цветные металлы, как правило, в виде сплавов, так как в чистом виде они обладают недостаточной прочностью. Наибольшее распространение получили сплавы на основе меди, алюминия, титана, олова, магния и других металлов.

Алюминий . В природе алюминия в самородном виде нет. Встречается только в виде соединений. Основным сырьём для промышленного производства алюминия служат бокситы и нефелины, которые содержат до 60% оксида алюминия (глинозема). Процесс получения алюминия является довольно сложным, энергоёмким и включает: получение из бокситов вначале глинозёма, а затем восстановление из раствора глинозёма электролизом в расплавленном криолите металлического алюминия. Образующийся в результате электролиза жидкий алюминий собирается на дне ванны под слоем электролита. Его называют алюминием-сырцом. Он содержит в своём составе металлические и неметаллические примеси, а также газы. Поэтому алюминийсырец рафинируют. После рафинирования образуется технически чистый алюминий, называемый первичным. Расплавленный металл разливается в определенные формы и отправляется в прокатное производство. Выпускается в виде заготовок, отливок, чушек, слитков, катанки, ленты и других изделий.
В зависимости от химического состава и содержания примесей алюминий подразделяется на марки: алюминий особой чистоты А999 (99,999% Аl), высокой чистоты марок: А995 (99,995% Аl), А99 (99,99% Аl), А98 (99,98% Аl), А97 (99,97% Аl), А95 (99,95% Аl) и технической чистоты, допускающих содержание примесей 0,15…1,0% (А85, А8, А7, А6, А5, А35 и А0). Массовую долю алюминия в металле определяют по разности 100,00% и суммы массовых долей определяемых примесей, массовая доля каждой из которых равна или более: для алюминия высокой чистоты – 0,001%, технической чистоты – 0,01%. Например, марка А85 обозначает, что в металле содержится 99,85% алюминия, а в марке А0 – 99% алюминия. В качестве примесей в алюминии могут присутствовать Fe, Si, Cu, Mn, Zn и др. Примеси оказывают существенное влияние на электрические и технологические свойства алюминия, его коррозионную стойкость.
Алюминий представляет собой серебристо-белый лёгкий металл с высокой тепло- и электропроводностью, хорошей коррозионной стойкостью в атмосфере и во многих агрессивных средах. По электропроводности он занимает третье место после серебра и меди. Чем чище алюминий, тем выше его электропроводность и коррозионная стойкость.
На воздухе алюминий покрывается тонкой прочной беспористой плёнкой оксида алюминия (Аl2O3) толщиной примерно 10 нм, защищающей металл от дальнейшего 32 окисления и обусловливающей его высокую коррозионную стойкость. Однако в щелочных средах и некоторых неорганических кислотах алюминий быстро разрушается.
Алюминий обладает высокой технологической пластичностью, сваривается, полируется, но относительно плохо обрабатывается резанием из-за высокой вязкости и налипания металла на инструмент. Вместе с тем он хорошо обрабатывается давлением, поэтому применяется для изготовления тонких листов, проката, в том числе и фольги различного назначения. При холодной пластической деформации (прокатка, волочение) в результате наклёпа получают твёрдый алюминий (АТ), который имеет повышенные механические характеристики (прочность, твёрдость), но при этом снижается относительное удлинение.
В чистом виде алюминий применяют для изготовления фольги, порошка, проволоки. Алюминиевую фольгу (альфоль) в строительстве применяют в качестве эффективного утеплителя (для отражения тепловых лучей) или декоративного материала, порошок – в качестве наполнителя (пигмента) в лакокрасочных составах или газообразователя при изготовлении ячеистых бетонов, проволоку – для сварки конструкций и т. д.
Общая характеристика алюминиевых сплавов

Как железо, так и алюминий в строительстве редко используются в чистом виде. Наибольшее применение находят алюминиевые сплавы. Сырьем для их получения служат как технически чистый алюминий, так и двойные сплавы алюминия с кремнием, которые содержат 10…13% Si и немного отличаются друг от друга количеством примесей железа, кальция, титана и марганца. Общее содержание примесей в них составляет 0,5…1,7% и называют их, как правило, силуминами. Основными легирующими компонентами алюминиевых сплавов являются Cu, Mg, Zn, Mn, Zr и реже – Cr, Li, Ni, Ti, Sc, V, Be и некоторые редкоземельные элементы.
Алюминиевые сплавы сочетают в себе, как правило, лучшие свойства чистого алюминия и повышенные прочностные и эксплуатационно-технологические характеристики легирующих добавок. Например, сплавы с магнием или цинком после термической обработки приобретают прочность, сравнимую с прочностью конструкционной стали с низким содержанием углерода. При этом такой сплав в 2,9 раза легче стали. Прочность на растяжение алюминиевых сплавов составляет 100…700 МПа, относительное удлинение – 6…22%, модуль упругости – 65500…72400 МПа. По прочности их подразделяют на малопрочные (до 300 МПа), среднепрочные (300…480 МПа) и сверхпрочные (более 480 МПа).
Недостатком алюминиевых сплавов являются сравнительно низкий модуль упругости (почти в три раза меньше, чем модуль упругости стали), высокий коэффициент линейного расширения и относительная сложность соединения элементов конструкций.
Алюминиевые сплавы классифицируют по составу, технологии получения заготовок, способности к термической обработке и основным потребительским свойствам. В зависимости от состава различают силумины (Al – Si), магналии (Al – Mg), дюралюмины (Al – Cu – Mg), авиали (Al – Mg – Si) и более сложные (многокомпонентные) с улучшенными свойствами – высокопрочные, жаропрочные, коррозионностойкие и др.
По технологическому признаку (способу изготовления) все алюминиевые сплавы делят на деформируемые (имеющие высокую пластичность в нагретом состоянии) и обрабатываемые давлением – методом горячей или холодной деформации (дюралюмины) и литейные (имеющие хорошую жидкотекучесть), применяемые для отливки изделий (силумины).

Для получения деформируемых сплавов в алюминий вводят в основном растворимые в нем легирующие элементы в количестве, не превышающем предел их растворимости при высокой температуре. Такими легирующими элементами в различных деформируемых сплавах являются медь, магний, марганец и цинк. Кроме того, в сравнительно небольших количествах вводят кремний, железо, никель и др. Наиболее распространенными литейными сплавами являются составы с кремнием или магнием (силумины или магналии).
Как деформируемые, так и литейные алюминиевые сплавы (ГОСТ 4784) подразделяют на термически не упрочняемые и термически и механически упрочняемые. Механическое упрочнение (нагартовка, наклеп) производится обжатием сплава в холодном состоянии. Термическая обработка состоит в закалке сплава нагреванием до температуры 440…510℃ и быстром охлаждении с последующим естественным (при обычных температурах) или искусственным (при t=150℃) старением.
В зависимости от назначения и требований в отношении физико-механических, технологических и других свойств их разделяют на сплавы высокой, средней и малой прочности, свариваемые, заклепочные, декоративные и другие. Они подразделяются также по системам, в которых основные легирующие элементы будут определять типичные для данной системы физические и химические свойства.
В строительстве применяются деформируемые термически упрочняемые и неупрочняемые и литейные, как термически упрочняемые, так и термически не упрочняемые алюминиевые сплавы (ТКП EN 1999-1 Еврокод 9). Однако в строительных конструкциях применяют в основном деформируемые сплавы системы алюминий-магнийкремний и другие. Деформируемые сплавы системы алюминий-магний-кремний наряду с хорошей пластичностью обладают такими свойствами, как высокая коррозионная стойкость, технологичность, способность подвергаться цветному анодированию и эмалированию и др.
Дюралюмины . Это класс сплавов системы «алюминий – медь – магний». Содержание меди составляет 2,2…4%, магния – 0,5…2,4% и в небольших количествах содержатся марганец (0,3…0,9%), кремний и железо. Однако метод изготовления дюраля заключается не только в специфическом подборе компонентов, но и в технологии его изготовления – механизме искусственного или естественного старения с помощью закалки. В результате сплав приобретает высокий уровень свойств при небольшой плотности.

Дюралюмины характеризуются сочетанием высокой прочности и пластичности, хорошо деформируются в горячем и холодном состояниях. Твёрдость и прочность их примерно такая же, как и у сталей обыкновенного качества. Однако при близких значениях прочности коэффициент конструктивного качества у дюралюминов значительно выше. При этом наибольшей прочности дюралюмины достигают при содержании в составе 4% меди и 1% магния. Такие сплавы называются супердюралюмины.
Дюралюмины удовлетворительно обрабатываются резанием в закалённом и состаренном состояниях и плохо в отожжённом, хорошо свариваются точечной сваркой и не свариваются сваркой плавлением из-за образования трещин. Наиболее известны сплавы Д1, Д16, Д18, Д19 и др. Например, сплав Д16 используется в строительных конструкциях средней и повышенной прочности.
Недостатком дюралюминов является их пониженная коррозионная стойкость. Для защиты от коррозии дюралюмины плакируют чистым алюминием, подвергают электрохимическому оксидированию либо естественному старению.
Силумины . Это группа литейных сплавов алюминия с кремнием (4…22%) и незначительным количеством примесей – железа, меди, магния, титана, цинка и других элементов (ГОСТ 1583). Название произошло от наличия в составе химического элемента Si. Силумины дополнительно могут быть легированы магнием, медью, никелем, титаном, что позволяет упрочнять такие сплавы термической обработкой. По сравнению с чистым алюминием обладают большей прочностью и износостойкостью, но уступают по этим показателям дюралюмину. Для силуминов характерна низкая литейная усадка, стойкость к коррозии и высокая твердость. Применяют при изготовлении строительных конструкций.
Магналии. Магналии – сплавы алюминия с магнием Mg до 10% и другими элементами (кремний, железо, медь). В зависимости от содержания магния различают деформируемые (до 7% Mg) и литейные (5…10% Mg) сплавы. Магний уменьшает плотность алюминиевого сплава, повышает прочность и коррозионную стойкость без снижения пластичности. Поэтому основным преимуществом таких сплавов является сочетание сравнительно высокой прочности, пластичности и коррозионной стойкости с хорошей свариваемостью. Магналии легко поддаются механической обработке и хорошо полируются. Применяются в качестве конструкционного и декоративного материала. Авиаль (сокращенное от «авиационный алюминий») – группа сплавов системы алюминий – магний (0,45…0,9%) – кремний (0,5…1,2%) с небольшим содержанием других элементов марганца или хрома (0.15…0,35%), меди (0,2…0,6%) и железа – не более 0,5%.
Авиали. Авиали относятся к числу сплавов со средней прочностью, но высокой технологичностью и стойкостью против атмосферной коррозии. Отличаются высокой пластичностью и свариваемостью, хорошо полируются. Для упрочнения подвергают закалке и искусственному старению. В строительстве применяются в виде профилей, труб, обшивки строительных конструкций и других изделий.
Маркировка алюминиевых сплавов

Единой системы маркировки черных и цветных металлов, в т. ч. алюминиевых сплавов в мировом сообществе не разработано. Маркировку алюминиевых сплавов в РБ и в странах СНГ определяют в основном стандарты: ГОСТы 1583 и 4784, ГОСТ Р 55375 и EN 573-1. Отличия в системах маркировки алюминиевых сплавов вызваны различием в технологиях производства, требованиях к свойствам, области применения и другим параметрам. В настоящее время осуществляется замена различных систем условных обозначений на единую систему цифровой маркировки алюминиевых сплавов.
Что касается европейских норм, то они предусматривают раздельные системы маркировки (кодирования) для деформируемых и литейных алюминиевых сплавов, основанные на Международной системе обозначений. Деформируемые алюминиевые сплавы имеют, как правило, буквенно-цифровую систему маркировки. Обозначение последовательно составляется из букв EN, затем следует пробел, букв А (алюминий) и W (деформируемый полуфабрикат), дефис и четырех цифр, представляющих химический состав, и при необходимости за ними буквы, указывающей национальную вариацию. Например, EN AW-5154А.
Литейные сплавы тоже имеют буквенно-цифровое обозначение, которое состоит из тех же букв EN, A и далее букв, указывающих на форму полуфабриката (А, С, М) и пяти цифр, показывающих их пределы содержания элементов химического состава. Например, EN AВ-44000.
Медь . Медь (лат. сuprum – от названия острова Кипр, где в древности добывали медную руду) среди цветных металлов по объёму потребления занимает второе место после алюминия. В чистом виде в природе встречается крайне редко в виде самородков, в которых содержание меди может доходить до 99%. В промышленном масштабе производят в основном из руд, либо из отходов меди и её сплавов. Наиболее востребованными рудами для производства меди являются сульфидные – медный колчедан (CuS·FeS), халькозин (Cu2S), ковеллин (CuS) и др., содержащие до 5% меди. Технологический процесс производства меди является довольно сложным и длительным по времени (несколько суток). Он включает подготовку руды к плавке (обогащение) и получение медного концентрата с содержанием меди до 35%. Затем производят обжиг медного концентрата, плавку и получение так называемого медного штейна. Последующими технологическими операциями являются плавка штейна (сократительная) с целью повышения содержания в нем меди, конвертирование медного штейна – получение сначала белого штейна с содержанием меди до 79%, а затем черновой (сырой) меди, содержащей уже более 99% Сu. При этом примеси переходят в шлак и удаляются, а чистую медь разливают в формы. Заключительным этапом является электролитическое рафинирование отливок и получение меди необходимой чистоты.
Свойства полученной меди (ГОСТ 859) зависят от чистоты, а уровень содержания примесей определяет её марку: М00к – не менее 99,99% Сu, М0к – 99,97% Сu, М1к – 99,95% Сu, М2к – 99,93% Сu и др. В обозначении марок после буквы М (медь) указывается условный номер чистоты, а затем буквой способ и условия получения меди: к – катодная; б – бескислородная; р – раскисленная; ф – раскисленная фосфором. Вредными примесями, снижающими механические и технологические свойства меди и её сплавов, являются свинец, висмут, сера и кислород. Содержание их в меди строго ограничено: висмута – не более 0,005%, свинца – 0,05% и т. д. Все примеси, как правило, снижают и электрическую проводимость меди.
Цвет меди – красноватый (в изломе розовый), в очень тонких слоях на просвет зеленовато-голубой. Эти же цвета характерны и для многих соединений меди. Медь – единственный металл, имеющий красноватый цвет. Это и отличает её от всех других металлов. Чистая медь обладает высокой электро- и теплопроводностью, наивысшей после серебра. Поэтому медь принято считать эталоном электро- и теплопроводности по отношению к другим металлам. Характеристики этих свойств меди и сплавов с её высоким содержанием по международному стандарту на отожжённую медную проволоку (IACS) принимаются за 100%, в то время как у алюминия, магния и железа они составляют соответственно 60, 40 и 17% от свойств меди.



Медь относится к малоактивным металлам. При обычных условиях она не взаимодействует с водой, растворами щелочей, соляной и разбавленной серной кислотой. Однако, в других кислотах (азотной, концентрированной серной) – медь растворяется. При взаимодействии её с уксусной кислотой образуется основной ацетат меди – ядовитая ярь-медянка. Способность меди растворяться в азотной кислоте используется в промышленности для определения её наличия в сплавах. Если кислота при взаимодействии с образцом металла приобретает сине-зелёный цвет, значит в составе металла присутствует медь.
На воздухе и в сухих условиях медь не окисляется. При наличии же углекислого газа и влаги медь окисляется и покрывается тонкой плёнкой карбоната меди под названием «патины» зелёного цвета. В дальнейшем эта плёнка в определённой мере способна защищать медь от коррозии.
Медь в чистом виде обладает высокой пластичностью и отличной обрабатываемостью давлением в холодном и горячем состояниях, хорошими литейными свойствами. Температура её плавления составляет 1083℃. Она хорошо прокатывается в тонкие листы и ленту, из неё получают тонкую проволоку. При этом холодная пластическая деформация (достигающая 90% и более) увеличивает прочность, твёрдость, предел упругости меди, но снижает пластичность и электрическую проводимость. Медь хорошо паяется и сваривается. Обладает хорошим блеском и высокой полируемостью, однако блеск её довольно быстро исчезает. Недостаток меди – сравнительно невысокая прочность, плохая обрабатываемость резанием и низкая жидкотекучесть.
Технически чистую медь поставляют в виде листов или полуфабрикатов – слитков, предназначенных для дальнейшего передела прокаткой. В строительстве медь применяется в основном для изготовления водопроводных труб, кровельной черепицы и других изделий. Более 30% меди используется для производства медных сплавов.
Для легирования медных сплавов используют элементы, растворимые в меди – Zn, Sn, Al, Be, Si, Mn, Ni. В зависимости от легирующего элемента все сплавы меди подразделяются на латуни, бронзы и медноникелевые.

Латунь. Это сплавы меди с цинком и другими элементами, в которых цинк является основным легирующим элементом (ГОСТы 15527 и 17711). На практике применяют латуни двойные и специальные (легированные). Цинк повышает прочность и пластичность сплава, но до определенных пределов. Наибольшей пластичностью обладают латуни, содержащие 30% цинка, а наибольшей прочностью – 45%. Латуни имеют золотисто-жёлтый цвет и по сравнению с медью обладают большими прочностью, твёрдостью, упругостью, коррозионной стойкостью и лучшими технологическими свойствами (жидкотекучестью, обрабатываемостью литьём, давлением, резанием). Электро- и теплопроводность латуней тоже ниже, чем меди.
Бронза. Бронза является одним из древнейших металлических материалов. Она дала название целой эпохе развития человечества – бронзовому веку. В настоящее время бронзой называют медные сплавы, обычно с оловом как основным легирующим компонентом, и другими металлами кроме цинка и никеля. Цинк и никель могут вводиться в бронзы только как дополнительные легирующие элементы. При этом медноникелевые сплавы выделяют в особую группу. Следовательно, по химическому составу бронзы подразделяют на оловянные и безоловянные, а название получают по основному легирующему элементу, образующему сплав (алюминиевые, кремнистые и др.).
В целом же бронзы по сравнению с латунями обладают лучшими механическими, антифрикционными свойствами и антикоррозионной стойкостью. Структура и свойства их изменяются в зависимости от содержания легирующих элементов, скорости охлаждения сплава, разновидности и характера термической и других видов обработки. Отжиг, например, снимает напряжения, устраняет наклёп и позволяет получать сплавы однородной структуры. Закалка при температуре 700…750℃ без отпуска увеличивает пластичность сплава, а с отпуском – повышает прочность и твёрдость.
Сплавы меди, никеля и других элементов, в которых основным легирующим элементом является никель, называют медноникелевыми. Как правило, они имеют серебристо-белый цвет, несмотря на преимущественное содержание меди. Введение никеля существенно упрочняет медь, не меняя практически характеристик пластичности и ударной вязкости. При этом повышается коррозионная стойкость, технологичность, сплав приобретает особые электрические свойства. По назначению медноникелевые сплавы подразделяют на конструкционные и электротехнические. К конструкционным относятся высокопрочные и коррозионностойкие сплавы типа куниаль, нейзильбер и мельхиор, к электротехническим – копель, манганин и константан.
Металлические изделия

Определение и классификация . Металлургическая промышленность выпускает металлические изделия различной номенклатуры. Наиболее массовым видом продукции металлургических предприятий является металлический прокат – изделия, получаемые на прокатных станах путём горячей или холодной прокатки (холодное 39 формование). Выпускаются также гнутые, кованые, калиброванные и со специальной отделкой поверхности металлические изделия (ГОСТ 1435 и 1050)
Материалом для изготовления металлических изделий являются различные виды стали (от углеродистых до высоколегированных) и цветные металлы и сплавы (алюминиевые, медные и др.). По состоянию материала металлопродукцию (состоянию поставки) изготовляют изделия без термической обработки, термически обработанной, нагартованной (для калиброванной и со специальной отделкой поверхности) и подвергнутой противофлокенной обработке (выдержке при определенной температуре и последующему замедленному охлаждению).
Весь перечень металлического проката называется сортаментом и условно подразделяется на сортовой, толстолистовой, широкополосный универсальный, фасонный и гнутые профили (ГОСТ 535 и 19281). К сортовому относят прокат, у которого касательная в любой точке контура поперечного сечения данное сечение не пересекает. Прокат выпускается в листах, прутках, мотках, рулонах (штрипсах), полосовой и различного профиля.
Изделия сортового проката производят:
· круглого сечения диаметром от 5 до 330 мм. Прокат диаметром до 9 мм включительно выпускается в мотках, свыше 9 мм – в прутках длиной от 2 до 13 м (ГОСТ 2590);
· квадратного сечения с размерами сторон от 6 до 200 мм в мотках и прутках длиной от 2 до 13 м (ГОСТ 2590);
· шестигранного сечения диаметром вписанного круга от 8 до 103 мм в мотках и прутках длиной от 2 до 13 м (ГОСТ 2879);
· прямоугольного сечения (полоса) толщиной от 4 до 80 мм, шириной от 10 до 200 мм, длиной от 2 до 13 м и других размеров (ГОСТ 103). Кроме того, выпускают прокат:
· толстолистовой, тонколистовой и широкополосный универсальный, в т. ч. рулонный (штрипс) горячекатаный, холоднокатаный и оцинкованный шириной 500 мм и более, толщиной от 0,35 до 160 мм повышенной и обычной точности (ГОСТ 82, 19903, 19904, 16523, 9045, 14637, 14918 и 1577);
· арматуру (прокат арматурный) – изделия для армирования железобетонных конструкций (СТБ 1704, ГОСТ Р 52544);
· листы горячекатаные – просечно-вытяжной и рифленый с односторонним ромбическим, чечевичным (ГОСТ 8568) и другими видами рифления (в листах и рулонах);
· ленту стальную (холоднокатаную и горячекатаную) шириной от 20 до 220 мм и толщиной от 1,2 до 5 мм и другие изделия.
Основными качественными характеристиками таких изделий являются точность прокатки (повышенная, обычная и др.), отклонения в размерах и форме поперечного сечения и другие на соответствие стандарта.

К фасонному относят прокат, у которых касательная хотя бы в одной точке контура поперечного сечения данное сечение пересекает. Поперечное сечение таких изделий напоминает латинские буквы L (уголок), U (швеллер) и H (двутавр):
· уголки равнополочные размером от 20х20 до 250х250 мм и неравнополочные размером от 30х20 до 200х125 мм (ГОСТ 8509 и 8510);
· швеллеры высотой от 50 до 400 мм и шириной полок от 32 до 115 мм (ГОСТ 8240);
· двутавры с уклоном внутренних граней и полок высотой от 100 до 600 мм и шириной полки от 55 до 190 мм (ГОСТ 8239) и с параллельными гранями полок высотой от 100 до 1000 мм и шириной полок от 55 до 400 мм (ГОСТ 26020);
· профили специального назначения – профилированные листы (профнастил, гофролист) представляют собой стальные холодногнутые листовые профили в форме волны, прямоугольника или трапеции. Изготавливаются в стеновом и кровельном исполнении (ГОСТ 24045).
· кованые прутки квадратные и круглые (ГОСТ 1133), калиброванную холоднотянутую и холоднокатанную сталь круглого сечения (ГОСТ 7417), кованые полосы (ГОСТ 4405);
· профили гнутые различных поперечных сечений, изготовляемые на профилегибочных станах из холоднокатаного или горячекатаного проката, имеющие поперечное сечение одинаковое по всей длине (ГОСТ 14350).
Для стальных строительных конструкций используют листовую и сортовую сталь. Кроме того, применяют вторичные профили: сварные, получаемые сваркой полос или листов, и гнутые, образованные холодной гибкой полос и листов.
Из цветного металлопроката самыми востребованными в строительстве являются изделия на основе алюминия, меди и титана (ГОСТ 1535, 1628, 21488). Например, алюминиевые сплавы широко применяются для производства листов (ГОСТ 21631), плит (ГОСТ 17232), лент (ГОСТ 13726), различных профильных полуфабрикатов (ГОСТ 8617 и 24767), труб (ГОСТ 18475 и 18482), проволоки, для изготовления кровельных настилов, стеновых панелей, оконных и фонарных переплетов и других изделий (ГОСТ 4784 и 22233, ГОСТ Р 57352/EN 1090-3, СТБ EN 485, 573, 755, 12020).
Профильные полуфабрикаты включают прессованные и холодногнутые профили, листы и ленты (в рулонах), профилированные листы (гофрированные), тисненые листы. Профили могут быть сплошного и переменного сечений, пустотелые (полые) и в виде панелей. Применяют их в ограждающих и несущих конструкциях (балки, арки, фермы, рамы), для окон и дверей, солнцезащитных устройств, при ремонте и модернизации зданий. Изделия, которые изготавливает наша производственная из металлического проката компания приведены ниже:
Источник https://sar-svarka.ru/stanki-i-instrumenty/kakie-metally-otnosyatsya-k-legkim.html
Источник https://mdx-mini.ru/vidy-metallov/kakie-metally-otnosyatsya-k-legkim.html
Источник https://vertical-opora.ru/metally-ih-svojstva-i-raznovidnosti






