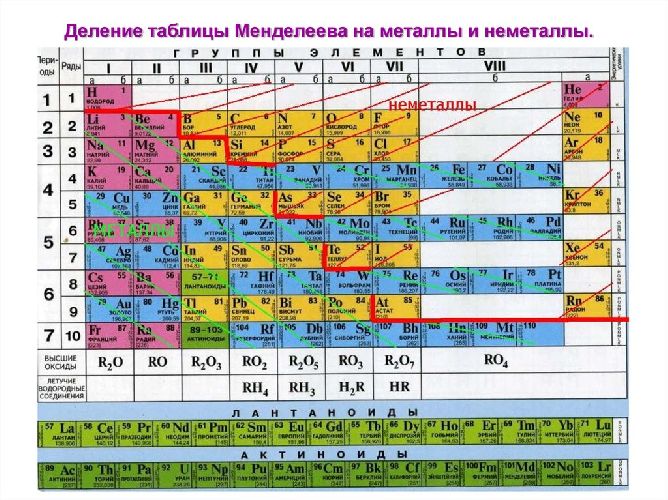
Металлы. Свойства, характеристики металлов
Металлы (от лат. metallum – шахта, рудник, копь) – наиболее широко используемый класс конструкционных материалов, применение которых наряду с неметаллами и композитами позволяет решать почти любые технологические задачи. К металлам принято относить элементы, обладающие характерными металлическими свойствами (высокой тепло- и электропроводностью, повышенной пластичностью и т. д.).
Число элементов, проявляющих свойства металлов, гораздо больше по сравнению с числом элементов, характеризующихся неметаллическими свойствами. Металлы расположены в I и II группах Периодической системы Д. И. Менделеева, а также образуют побочные подгруппы III–VIII групп. Ряд элементов проявляет амфотерные свойства (амфотерность – двойственность, способность некоторых соединений в зависимости от условий демонстрировать как кислотные, так и основные свойства).
Металлические свойства элементов определяются способностью атомов при взаимодействии с атомами других элементов частично или полностью смещать к ним электронные облака или «отдавать» электроны, т. е. проявлять при взаимодействии восстановительные свойства.

К самым активным металлам относятся элементы, обладающие:
- низкой энергией ионизации;
- большим радиусом атома;
- малым числом внешних электронов;
- небольшим значением электроотрицательности.
По мере заполнения внешнего энергетического уровня электронами их число на валентном уровне атомов элементов растет, а радиус атомов уменьшается, поэтому в большей степени проявляется склонность атомов к присоединению, а не к отдаче электронов. В связи с этим в периоде при движении слева направо металлические свойства элементов постепенно уменьшаются, а неметаллические – увеличиваются.
Имея больший радиус атома, металлы характеризуются, как было сказано выше, сравнительно низкими значениями энергии ионизации, сродства к электрону и электроотрицательности. Эти особенности влияют на преобладание у металлов восстановительных свойств, т. е. способности их атомов отдавать электроны. Ярче всего восстановительные свойства выражены у атомов металлов I и II групп главных подгрупп или у s-элементов. Самым сильным восстановителем является франций, а в водной среде – литий, выделяющийся за счет более высокого значения энергии гидратации образующихся катионов металла.
Число элементов, проявляющих металлические свойства, внутри периодов возрастает по мере увеличения номера периода. Так, во втором периоде это два элемента, в третьем – три, в четвертом – тринадцать и т. д.
В Периодической таблице металлические элементы отделены от неметаллических диагональной линией, проходящей от бора к астату. Вдоль этой границы располагаются элементы, одновременно проявляющие свойства и металлов, и неметаллов. К ним относятся бор, кремний, германий, мышьяк, сурьма, теллур и астат, которые называются полуметаллами или металлоидами. Таким образом, внутри каждого периода имеется «пограничная зона», где располагается элемент, имеющий двойственные свойства. Соответственно переход от типичного металла к типичному неметаллу в периоде происходит постепенно.
Начиная с 3-го периода у атомов появляются новые подуровни. Поэтому увеличивается число свободных орбиталей и, следовательно, возрастает между атомами количество связей, способствующих образованию сложных молекул, таких как комплексные соединения. В комплексных соединениях связь чаще всего образуется по донорно-акцепторному механизму. В роли акцептора, как правило, выступает положительно заряженный ион металла. Практически все элементы могут исполнять роль комплексообразователя, но наибольшее число комплексных соединений характерно для d-элементов 4-, 5- и 6-го периодов системы. Следовательно, элементы побочных подгрупп (В) более склонны к комплексообразованию, чем элементы главных подгрупп (А).
1. Физические свойства металлов
Почти все металлы, за исключением франция и ртути, в стандартных условиях находятся в твердом состоянии. При нагревании до определенной температуры они плавятся, а при еще более высоких температурах переходят в газообразное состояние.

Твердость металлов, а также их температура плавления обусловлены прочностью пространственной кристаллической решетки. Самые мягкие – щелочные металлы, которые легко режутся ножом. Наиболее твердые – металлы VIВ группы, особенно хром; по твердости он приближается к алмазу и режет стекло.
Изменение температуры плавления можно проследить по таблице Д. И. Менделеева: каждый период начинается с металла, имеющего очень низкий показатель. По мере увеличения заряда ядра атома температура плавления растет и достигает максимума в группе хрома, где находится самый тугоплавкий металл – вольфрам (3390 °С). Далее она снижается
и достигает минимума в подгруппе цинка, где находится самый легкоплавкий металл – ртуть (–38,9 °С). Металлы, температуры плавления которых выше 1000 °С, называют тугоплавкими, а ниже 100 °С – легкоплавкими.
Металлический блеск является следствием отражения световых лучей, а его интенсивность определяется долей поглощаемого света. Большинство металлов почти полностью отражают свет всех длин волн спектра, в связи с чем имеют белый или серый цвет. Наиболее ярко блестят палладий и серебро. Некоторые металлы (медь, золото, цезий) поглощают зеленый или голубой свет сильнее, чем свет других длин волн, поэтому окрашены в желтый или красный цвета.
В мелкораздробленном состоянии многие металлы теряют блеск. Например, железо, платина, хром становятся черного или серого цвета, тогда как алюминий и магний в порошкообразном состоянии продолжают блестеть. Интенсивность блеска зависит от доли поглощенного света: чем меньше света поглощает металл, тем более интенсивным будет блеск.
Все металлы полностью отражают радиоволны, что используется для обнаружения различных металлических объектов с помощью радиоволн (радиолокация).
Теплота сублимации – это характеристика, представляющая собой энергию, необходимую для перевода определенной массы металла в парообразное состояние. Теплота сублимации является мерой прочности связи в кристаллической решетке металла. В каждом периоде таблицы Д. И. Менделеева с увеличением порядкового номера теплота сублимации возрастает и достигает максимума для металлов подгруппы хрома, затем снижается до минимального значения в подгруппе цинка. Характер изменения значений теплоты сублимации в побочных подгруппах аналогичен изменению температур плавления и кипения металлов.
Электропроводность обусловлена присутствием в металле свободных электронов, которые направленно перемещаются при наложении электрического тока. Металлы – проводники 1-го рода, поскольку проводят электрический ток без изменений своей структуры. При нагревании электропроводность уменьшается, так как усиливается колебательное движение ионов, что затрудняет движение электронов. При охлаждении же электропроводность возрастает. Вблизи абсолютного нуля она стремится к бесконечности – это так называемое явление сверхпроводимости.
Теплопроводность – это свойство металлов, обеспечиваемое взаимодействием электронов проводимости с ионами, находящимися в узлах кристаллической решетки. Теплопроводность связана с электропроводностью: у металлов с высокой электропроводностью теплопроводность так же высока.
Пластичность металлов представляет собой легкость деформации, особенно проявляющуюся при высоких температурах. Обусловлена она тем, что под внешним воздействием одни слои в кристаллах легко перемещаются (скользят) относительно других без разрыва. Благодаря этому большинство металлов прокатывается в листы, вытягивается в проволоку, поддается ковке, прессованию и т. д. Наиболее пластичны золото, серебро и медь. Механически прочные металлы деформируются только под воздействием больших нагрузок.
Плотность – это критерий, лежащий в основе разделения металлов на легкие и тяжелые. Металлы, плотность которых меньше 5 г/см 3 , условно принято называть легкими, а более 5 г/см 3 – тяжелыми. Самый легкий из металлов – литий (плотность 0,53 г/см 3 ), а самый тяжелый – осмий (плотность 22,6 г/см 3 ). К легким относятся щелочные, щелочноземельные металлы, а также бериллий, алюминий, скандий, иттрий и титан, а к тяжелым – все остальные.
Плотность металлов связана с температурой их плавления. Легкие металлы обычно самые легкоплавкие, например, цезий с плотностью 1,87 г/см 3 плавится при температуре +28 °С, а вольфрам с плотностью 19 г/см 3 имеет температуру плавления, равную +3380 °С.
Фотоэлектрический эффект – это свойство металлов выбрасывать электроны с поверхности под действием электромагнитных волн, что обусловлено слабой связью валентных электронов с ядром. Чем слабее эта связь, тем меньше энергии необходимо для отрыва электрона. Именно поэтому в щелочных металлах фотоэлектрический эффект выражен сильнее.
На границе раздела двух металлов возникает контактная разность потенциалов, вызванная различной концентрацией электронов проводимости и разной работой выхода электронов у соприкасающихся поверхностей.
Полиморфизм – это явление существования металла в разных формах в твердом состоянии, или способность принимать различные кристаллические формы. Полиморфные модификации отличаются как внутренней структурой, так и физическими свойствами. Например, у железа известны α-, β-, γ-формы. Модификация α- железа устойчива при низких температурах, β– при более высоких.
Магнитные свойства присущи фактически всем металлам, поскольку они являются магнетиками – веществами, изменяющими или приобретающими магнитный момент под действием внешнего (стороннего) магнитного поля. Мерой измерения магнитных свойств металлов служат следующие величины: остаточная индукция, коэрцитивная сила и магнитная проницаемость (магнитная восприимчивость).
Металлы по магнитным свойствам могут быть разделены на три основные группы:
- диамагнетики – выталкиваются из магнитного поля и ослабляют его;
- парамагнетики – втягиваются магнитным полем, незначительно усиливая его;
- ферромагнетики – усиливают магнитное поле на порядки величин.
К диамагнетикам относятся такие металлы, как медь, серебро, золото, кремний, бериллий и металлы подгруппы цинка, галлия, германия. Им свойственна отрицательная магнитная восприимчивость, поскольку под действием внешнего магнитного поля в них возникает намагниченность, направленная ему навстречу. Парамагнетики – металлы с небольшой положительной восприимчивостью (в основном щелочные и щелочноземельные), которые намагничиваются в направлении внешнего поля. Ферромагнетики включают металлы, обладающие высокой магнитной восприимчивостью – это железо, кобальт, никель. Есть металлы и сплавы, которые не принадлежат трем упомянутым группам: антиферромагнетики (ряд редкоземельных металлов), ферриты (соединения оксида железа) и т. д.
Металлы, применяемые в технике, подразделяются на черные (железо и его сплавы), цветные (все остальные, включая магний и алюминий), драгоценные (золото, платина, палладий, иридий), редкие (цирконий, иттрий, лантан, церий и др.).
2. Типы кристаллических решеток
Все металлы в твердом состоянии представляют собой кристаллы. Кристалл – это совокупность атомов, расположенных в пространстве не хаотично, а в геометрически правильной последовательности. Пространственное расположение атомов и образует кристаллическую решетку.
В узлах пространственной кристаллической решетки металла правильно расположены положительно заряженные ионы, а между ними перемещаются свободные электроны – электронный газ. Переходя от одного катиона к другому, они осуществляют связь между ионами и превращают кристалл металла в единое целое. Эта связь, называемая металлической, возникает между атомами металлов за счет перекрывания электронных облаков внешних электронов. Металлическая связь отличается от неполярной ковалентной связи своей ненаправленностью. В кристалле металлического типа электроны не закреплены между двумя атомами, а принадлежат всем атомам данного кристалла, т. е. делокализованы. К особенности структуры металлических кристаллов относятся большие координационные числа – 8÷12, которым соответствует высокая плотность упаковки.
Кристаллическая решетка каждого металла состоит из положительно заряженных ионов одинакового размера, расположенных в кристалле по принципу наиболее плотной упаковки шаров одинакового диаметра.
Различают три основных типа упаковки, или кристаллической решетки.
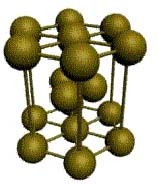
1. Объемноцентрированная кубическая решетка с координационным числом, равным 8 (натрий, калий, барий). Атомы металла расположены в вершинах куба, а один – в центре объема. Плотность упаковки шарообразными ионами в этом случае составляет 68 %.
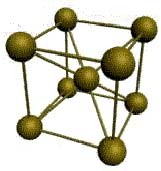
2. Гранецентрированная кубическая решетка с координационным числом, равным 12 (алюминий, медь, серебро). Атомы металла расположены в вершинах куба и в центре каждой грани. Плотность упаковки – 74 %.
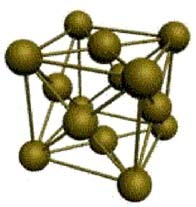
3. Гексагональная решетка с координационным числом 12 (магний, цинк, кадмий). Атомы металла расположены в вершинах и центре шестигранных оснований призмы, а еще три – в ее средней плоскости. Плотность упаковки – 74 %.
Из-за неодинаковой плотности атомов в различных направлениях кристалла наблюдаются разные свойства. Это явление, получившее название анизотропия, характерно для одиночных кристаллов – монокристаллов. Однако большинство металлов в обычных условиях имеют поликристаллическое строение, т. е. состоят из значительного числа кристаллов, или зерен, каждое из которых анизотропно. Разная ориентировка отдельных зерен приводит к усреднению свойств поликристаллического металла.
Особенности кристаллических решеток обусловливают характерные физические свойства металлов.
3. Характеристика химических свойств металлов
3.1. Восстановительная способность
Все металлы в свободном состоянии – восстановители, поэтому в соединениях их степени окисления всегда положительны. Химическая активность металлов, т. е. их способность отдавать электроны, может быть охарактеризована с помощью двух величин: энергии ионизации и стандартного электродного потенциала. Различие между этими величинами заключается в том, что энергия ионизации влияет на процесс отрыва электрона от атомов металлов в газовой фазе, а электродные потенциалы изменяют свойства металлов в растворах.
Энергия ионизации (Еи) – энергия, необходимая для удаления электрона из изолированного атома на бесконечно большое расстояние:
Электродный потенциал (Е 0 ) количественно характеризует способность металла отдавать электроны в растворе, т. е. его восстановительные свойства:
Интенсивность взаимодействия металлов с элементарными окислителями определяется не только энергией ионизации атома металла, но и энергией сродства к электрону, и энергией диссоциации молекулярного окислителя. Последнее служит объяснением более легкого окисления металлов галогенами, чем кислородом или азотом, обладающими высокими значениями сродства к электрону.
Внутри каждого периода таблицы Д. И. Менделеева при движении слева направо энергия ионизации повышается: наименьшей энергией характеризуется щелочной металл, а наибольшей – благородный газ. Тогда как в пределах одной группы с возрастанием заряда ядра энергия ионизации, наоборот, уменьшается, так как радиус атома увеличивается, а притяжение электрона к ядру ослабевает. Следовательно, в периоде восстановительная способность атомов элементов уменьшается, а в группе увеличивается.
Все металлы окисляются фтором и могут окисляться хлором. Большинство из них, кроме золота и платины, окисляются бромом в кислой среде. Продуктами такого взаимодействия являются высшие галиды металлов.
С кислородом металлы взаимодействуют менее энергично, что объясняется высоким значением энергии диссоциации его молекулы. Продуктами такого взаимодействия являются, как правило, оксиды, хотя в некоторых случаях возможно образование пероксидов.
С азотом многие металлы вообще не взаимодействуют. Лишь некоторые, способные гореть в атмосфере азота, образуют нитриды. Такая устойчивость обусловлена высокой энергией диссоциации молекулы азота. Атомарный же азот легко взаимодействует со многими металлами с образованием нитридов.
С серой почти все металлы взаимодействуют при нагревании. Особенно легко они реагируют на расплавленную серу. Продуктами такого взаимодействия являются сульфиды металлов.
С водородом активные металлы взаимодействуют с образованием гидридов. Легкость перехода атомов металлов в гидратированные ионы зависит не только от химической активности металла, но и от энергии гидратации его иона.
Сравним свойства двух металлов: лития и цезия. Оба они относятся к s-элементам I группы, но литий находится во втором периоде, а цезий – в шестом. Поскольку радиус атома цезия больше, чем радиус атома лития, то энергия ионизации лития (5,39 эВ) больше, чем цезия (3,89 эВ). Ионы лития лучше гидратируются, благодаря чему в водных растворах он является более сильным восстановителем. А вот в твердом виде наиболее активным металлом и эффективным восстановителем становится цезий.
Металлы при взаимодействии с кислородом (прямом или косвенном) образуют основные оксиды, гидроксиды которых проявляют основные свойства: металл (Ме) → основной оксид (МехОу) → гидроксид или [Ме(ОН)х] основание. Например:
Оксид и гидроксид кальция проявляют основные свойства, поэтому могут взаимодействовать с кислотными оксидами и с кислотами:
В периоде основные свойства оксидов и гидроксидов уменьшаются:
В группе основные свойства соединений увеличиваются:
Если металл может образовывать соединения с разными степенями окисления, то свойства соединений будут зависеть от степени окисления элемента.
С возрастанием степени окисления металла основные свойства соединений уменьшаются, а кислотные свойства увеличиваются:
Взаимодействие металлов с водородными соединениями зависит от агрегатного состояния водородного соединения и от температуры. В основном галогенводороды реагируют с металлами при высокой температуре. При этом образуются соответствующие галиды металлов и выделяется водород:
С активными металлами данная реакция протекает при обычной температуре.
Взаимодействие металлов с водой определяется их активностью. Активные металлы вытесняют водород из воды при комнатной температуре:
Действие воды на металлы усиливается в присутствии кислорода. Если малоактивные металлы в обычных условиях с водой не взаимодействуют, то в присутствии растворенного кислорода достаточно легко окисляются:
Сероводород (H2S) взаимодействует с металлами преимущественно при высоких температурах с выделением водорода и образованием сульфидов, а в случае активных металлов – гидросульфидов.
Газообразный аммиак (NH3) действует на металлы также при высоких температурах, образуя при этом нитриды или гидронитриды (амиды) металлов. Однако жидкий аммиак активными металлами разлагается:
Образование пассивных пленок. Взаимодействие многих металлов с фтором, хлором, бромом и кислородом тормозится пассивными пленками. Они образуются на поверхности металла и имеют особую структуру, благодаря которой обладают такими свойствами как прочность, высокая плотность, инертность и т. д. Наибольшая склонность к пассивации отличает алюминий, бериллий и d-металлы: титан, хром, железо.
Токсичность. Пыль и пары многих металлов являются токсичными. Примером могут служить бериллий, ртуть, свинец, кадмий, серебро, никель, таллий, радий, индий и т. д. Степень токсичности определяется значением предельно допустимой концентрации (ПДК). Так, для бериллия ПДК = 10 –3 мг/м 3 , для таллия – 10 –1 мг/м 3 .
Комплексообразование. Большинство металлов являются комплексообразователями за счет вакантных (свободных) орбиталей: [Cu(NH3)4]Cl2; K2[HgI4].
Способность к комплексообразованию возрастает с увеличением заряда иона-комплексообразователя и уменьшением его радиуса.
3.2. Отношение металлов к кислотам
Взаимодействие с серной кислотой – H2SO4
1. Разбавленная H2SO4. Окислителем в разбавленной серной кислоте является ион водорода Н + . Следовательно, в реакцию могут вступать металлы, чей
стандартный электродный потенциал меньше, чем у водорода (Е 0 Me > Е 0 H = 0) :
2. Концентрированная H2SO4. Окислителем в этом случае является атом серы со степенью окисления +6 – S +6 . В зависимости от активности металла реакция может быть разной:
- металлы низкой активности (Е 0 Me< Е 0 H ) восстанавливают серную кислоту до диоксида серы:
- металлы средней активности, для которых справедливо соотношение Е 0 Mn = – 1,05 ≤ Е 0 Me< Е 0 H, восстанавливают серу серной кислоты до простого вещества:
- металлы высокой активности ( Е 0 Me< Е 0 Mn ) вытесняют из серной кислоты сероводород, в котором степень окисления серы минимальна и равна – 2:
Взаимодействие с азотной кислотой – HNO3
1. Разбавленная HNO3. Окислителем в азотной кислоте всегда является атом N +5 , поэтому при взаимодействии с металлами из нее никогда не выделяется водород. Возможны три варианта взаимодействия металлов разной активности с разбавленной HNO3:
- металлы низкой активности ( Е 0 Me >Е 0 H ) способны восстанавливать азот азотной кислоты до степени окисления +2:
- металлы средней активности ( Е 0 Mn = – 1,05 ≤ Е 0 Me< Е 0 H) восстанавливают азотную кислоту до простого вещества N2 (или до закиси азота N2O):
- металлы высокой активности ( Е 0 Me< Е 0 Mn) способны восстановить азот азотной кислоты до минимальной степени окисления –3:
2. Концентрированная HNO3. В этом случае различают лишь два варианта взаимодействия с металлами:
- металлы низкой активности ( Е 0 Me >Е 0 H) восстанавливают азотную кислоту до диоксида азота NO2, в котором степень окисления азота равна +4:
- активные металлы (Е 0 Ме< Е 0 Н) при растворении в концентрированной кислоте выделяют из нее оксид азота (II):
Такие металлы, как Fe, Al, Cr, Ti не взаимодействуют с концентрированной HNO3 вследствие явления пассивации.
Разложение нитратов металлов разной активности. От активности металла зависит состав продуктов разложения солей азотной кислоты. Возможны три варианта термического разложения нитратов металлов разной активности:
- стоящие в ряду напряжений до Mg при разложении образуют соответствующие нитриты и кислород: MeNO3 → MeNO2 + O2;
- расположенные в ряду напряжений в диапазоне «Mg – Cu» разлагаются с образованием соответствующих оксидов, диоксида азота и кислорода: MeNO3 → MeO + NO2 + O2;
- находящиеся в ряду напряжений после Cu разлагаются с выделением металла в виде простого вещества, диоксида азота и кислорода: MeNO3 → Me + NO2 + O2.
4. Металлические сплавы
В твердом состоянии металлы практически не взаимодействуют друг с другом, однако в расплавленном состоянии могут иметь место и растворение, и взаимодействие. Различные расплавленные металлы в большинстве случаев смешиваются друг с другом в любых соотношениях, образуя жидкие однородные системы. В отдельных случаях наблюдается неполная взаимная растворимость. Например, расплавленные цинк и свинец при смешивании образуют двухслойную жидкую систему, фазы которой представляют собой растворы цинка в свинце и свинца в цинке.

Отличительные признаки смешанных металлических расплавов проявляются в процессе их кристаллизации при охлаждении в некотором температурном интервале. Система при этом затвердевает, образуя металлический сплав.
Металлические сплавы – это вещества, обладающие свойствами металлов и состоящие из двух и более компонентов, из которых хотя бы один является металлом.
Природа затвердевших сплавов зависит от отношения друг к другу составляющих их компонентов. При сходстве кристаллических решеток они взаимно растворимы друг в друге даже в твердом состоянии. Из их расплавов при охлаждении кристаллизуются твердые растворы, представляющие собой кристаллы с решетками, в узлах которых попеременно располагаются ионы составляющих металлов, например, медь – серебро. При близости параметров кристаллических решеток составляющих металлов наблюдается их неограниченная растворимость друг в друге, т. е. могут образовываться твердые растворы с любым содержанием исходных веществ. Системы с полной взаимной растворимостью – это непрерывные твердые растворы: Ag – Au, Ni – Co, Cu – Ni, Mo – W.
Твердые растворы металлов обладают свойствами, качественно напоминающими свойства индивидуальных металлов, но количественно отличающимися от них в зависимости от состава. Например, латунь (сплав Cu – Zn) имеет прочность на разрыв, которая в 3 раза больше, чем у меди и в 6 раз, чем у цинка, а нержавеющая сталь (сплав Fe – Cr – Ni) устойчива в разбавленной H2SO4, тогда как чистый металл Fe в ней растворяется.
Среди компонентов твердого раствора различают металл-растворитель и растворенный металл. Растворителем считается металл, сохраняющий свою кристаллическую решетку при образовании раствора, и содержание которого в растворе должно быть не меньше определенного значения. Ионы растворяемого металла постепенно замещают в кристаллической решетке ионы металла-растворителя (растворы замещения) или располагаются между ними (растворы внедрения). В том случае, когда различные металлы с близкими кристаллическими решетками способны образовывать твердые растворы в любых количественных соотношениях, отличить растворенный металл от металла-растворителя нет возможности: приходится считать, что они взаимно растворяют друг друга.
Ионы растворенного металла изменяют средние размеры элементарной ячейки металла-растворителя. При образовании твердых растворов замещения параметры решетки изменяются в зависимости от разности ионных диаметров растворенного металла и растворителя. При образовании твердых растворов внедрения параметры решетки увеличиваются, так как размеры ионов растворенного металла больше межионных помежутков, в которых они располагаются.
Однако чаще всего растворимость твердых металлов друг в друге ограничена, т. е. в твердой фазе содержание одного из металлов не может превысить некий предел. В этом случае при полном затвердевании расплава из двух металлов образуется неоднородный сплав, состоящий из двух твердых фаз, одна из которых представляет собой насыщенный раствор первого металла во втором, а другая – насыщенный раствор второго металла в первом. Иногда растворимость настолько ничтожна, что отдельные твердые фазы образовавшегося сплава можно считать состоящими практически из индивидуальных металлов.
Многие металлы, взаимно растворимые в расплавленном состоянии, при охлаждении образуют смесь кристаллов с различной кристаллической решеткой. Температура плавления (Тпл) такой смеси меньше Тпл отдельных компонентов.
Состав, имеющий минимальную Тпл, называется эвтектикой. Эвтектический сплав состоит из мельчайших кристаллов индивидуальных компонентов. Его образуют металлы очень близкие по природе, но существенно отличающиеся по типу кристаллической решетки, например, Рb – Sn, Pb – Sb, Cd – Bi, Sn – Zn. Эвтектические сплавы имеют высокую твердость и прочность.
В некоторых случаях при взаимодействии двух металлов образуются химические соединения, именуемые интерметаллидами. Большинство этих соединений устойчивы только в твердом состоянии, так как их формульный состав не соответствует классическим представлениям о валентности элементов, например, TiBe12. Очень часто интерметаллиды имеют переменный состав, так как в твердом состоянии способны растворяться в металлах и других интерметаллических соединениях.
Интерметаллиды представляют собой соединения с металлической связью между входящими в их состав атомами. Термическая прочность таких соединений невысока: большинство из них при плавлении частично или полностью разлагается.
Интерметаллические соединения выглядят как металлоподобные вещества. Однако типичные для металлов физические свойства у интерметаллидов проявляются слабее. Обычно у них и электропроводность меньше, чем у компонента с низшей электрической проводимостью, и теплопроводность, и блеск, и пластичность существенно уступают соответствующим элементарным металлам. По химическим же свойствам интерметаллиды им подобны. Некоторые сравнительно прочные интерметаллические соединения в расплавленном состоянии могут подвергаться электролизу, причем на катоде выделяется более активный металл, на аноде – менее активный.
Металлические сплавы можно получить разными способами. Например, спеканием, суть которого заключается в том, что при высокой температуре и под большим давлением в смеси порошкообразных металлов осуществляется их взаимная диффузия.
Другой способ получения металлических сплавов – электролиз смеси электролитов, при котором на катоде одновременно восстанавливаются ионы двух или более металлов.
Кроме того, металлические сплавы образуются при возгонке нескольких металлов, когда из смеси паров происходит одновременная конденсация, сопровождающаяся взаимной диффузией компонентов друг в друга.
Композиционные материалы. Композиты получают путем объемного сочетания химически разнородных компонентов при сохранении между ними границы раздела. Свойства композитов существенно отличаются от свойств входящих в них компонентов.
Композиты состоят из основы (матрицы) и добавок (порошки, волокна, стружка). В качестве основы используют металлы, керамику, полимеры.
- Если основой служат металлы, то добавками могут быть металлические нитевидные кристаллы, неорганические волокна и порошки: Al2O3, SiO2 и т. д.
- Если основой является керамика, то добавками выступают металлы. Например, основа – Al2O3, Cr2O3, MgO, ZrO2 и т. д., добавки – Mo, W, Ta, Ni, Co. Такие композиты называются керамико-металлическими материалами (керметами).
Композиты характеризуются высокой прочностью, твердостью, износостойкостью, благодаря чему их используют в качестве конструкционных материалов, контактов, подшипников, инструментов и т. д.
5. Распространение в природе и способы получения металлов
Значительная часть металлов находится в земной коре в виде различных соединений, и только малоактивные (благородные) встречаются в свободном или самородном состоянии.
Содержание наиболее распространенных металлов в земной коре можно представить следующим образом (масс. %): алюминий – 8,45; железо – 4,4; кальций – 3,3; натрий – 2,6; калий – 2,5; магний – 2,1; титан – 0,61.
Из природных соединений металлов в большей степени распространены оксиды, входящие в состав горных пород, и сульфиды (железа, никеля, меди, цинка и др.). Встречаются также фториды и хлориды – преимущественно щелочных и щелочноземельных металлов. Некоторые металлы присутствуют в виде солей кислородсодержащих кислот (карбонаты, силикаты, сульфаты, фосфаты и т. д.).
Главным источником получения металлов являются руды – скопления металлосодержащих минералов, входящих в состав горных пород. Металлы в составе руд находятся в окисленном состоянии, поэтому основным способом их получения является процесс восстановления. Если в руде содержатся разные металлы, ее подвергают расщеплению на отдельные соединения металлов путем химической обработки. Так, при воздействии на полиметаллические руды хлора (в присутствии восстановителя) образуются хлориды нескольких металлов, которые благодаря разной степени летучести могут быть отделены друг от друга и от непрохлорированной части руды. Чистые хлориды ряда металлов восстанавливают активными металлами до свободных металлов.

Иногда сложные полиметаллические руды с целью получения сложных сплавов подвергают восстановлению без предварительного разделения. Поскольку они бывают загрязнены так называемой пустой породой, которая затрудняет восстановление, то процессу получения металла предшествует очистка руды или ее обогащение механическими, химическими, физико-химическими и другими методами. Из физико-химических наибольшее распространение получил метод флотации, основанный на различной смачиваемости водой частиц смеси различных материалов.
Чистые оксиды металлов легче и удобнее поддаются процессу восстановления. В связи с этим водные оксиды обезвоживают, а сульфидные руды переводят в оксидные путем окислительного обжига.
Руды с небольшим содержанием металлов подвергают гидрометаллургической переработке водными растворами кислот или щелочей. При этом соединения некоторых металлов переходят в раствор.
Таким образом, наиболее распространенными способами получения металлов являются пирометаллургия и гидрометаллургия.
1. Пирометаллургия – восстановление металлов, при котором в качестве восстановителей используют углерод (карботермия), водород, металлы-восстановители (металлотермия):
Если при восстановлении соединений металлов используется алюминий, метод получения называется алюмотермией. Алюмотермические методы применяют при извлечении из оксидов тугоплавких металлов (ванадий, хром, молибден и др.). Иногда в качестве восстановителя требуется магний. Метод магнийтермии нашел применение при получении титана, циркония, тантала из хлоридов этих металлов.
Углерод по своей восстановительной активности уступает многим металлам. Тем не менее, карботермия имеет широкое распространение при восстановлении металлов малой активности (медь) и средней (железо, цинк, свинец).
2. Гидрометаллургия – восстановление металлов, протекающее из водных растворов их солей при обычной температуре. При этом восстанавливаемый металл находится в мелкораздробленном состоянии. В качестве восстановителей используют активные металлы.
3. Электрометаллургия – процесс получения металлов под воздействием постоянного электрического тока, протекающего через раствор или расплав соли металла:
Электролизом водных растворов получают сравнительно малоактивные металлы (медь, серебро, никель и т. д.). А электролизом расплавов солей – высокоактивные (щелочные и щелочноземельные металлы, алюминий).
Получение чистых металлов. Некоторые отрасли промышленности и техники нуждаются в металлах особой чистоты. Например, они востребованы при конструировании ядерных реакторов, в электронной и медицинской технике. Особо чистые металлы отличаются по своим физическим свойствам от обычных. Такие свойства, как пластичность, электро- и теплопроводность, а также сопротивление коррозии у чистых металлов имеют более высокие значения.
В настоящее время проблема получения чистых и сверхчистых металлов решается разными способами.
- Электролитическое рафинирование– процесс электролиза с использованием чернового металла в качестве анода (активного). При пропускании постоянного электрического тока через электролит черновой металл окисляется (растворяется), а на катоде, изготовленном из чистого металла, из раствора (расплава) восстанавливается (осаждается) металл.
- Термическая диссоциация летучих соединений– очистка, основанная на способности некоторых соединений металлов разлагаться при высокой температуре. Например, иодиды титана и циркония, являясь летучими соединениями, при повышении температуры разлагаются на чистый металл и йод.
- Зонная плавка– процесс, основанный на различной степени растворимости примесей в твердом и расплавленном состояниях. Через зону с высокой температурой медленно продвигают стержень из очищаемого металла. По мере продвижения расплавленная область, где собираются все примеси, постепенно перемещается в конец стержня, который входит в горячую зону последним. Операцию повторяют многократно, каждый раз механически отделяя от чистого металла конец стержня, содержащий примеси.
Металлы
Металлы — один из самых распространённых материалов, используемых цивилизацией на протяжении практически всей её истории.
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 [1] химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
11 в группе лёгких металлов,
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
вне определённых групп бериллий и магний.
Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Происхождение слова «металл»
Слово «металл» заимствовано из немецкого языка в старорусский период. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «. злато и сребро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М.В. Ломоносова.
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» – «рудник, металл». Латинское в свою очередь заимствовано из греческого языка (μεταλλον – «рудник, копь»). [2]
Нахождение в природе
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов [3] . Больше всего в наших клетках кальция и натрия, сконцентрированного в лимфатических системах. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Добыча
Основные статьи: Руда, Добыча полезных ископаемых, Металловедение
Металлы часто извлекают из земли средствами горной промышленности, результат — добытые руды — служат относительно богатым источником необходимых элементов. Для выяснения нахождения руд используются специальные поисковые методы, включающие разведку руд и исследование месторождений. Месторождения, как правило, делятся на карьеры (разработки руд на поверхности), в которых добыча ведётся путем извлечения грунта с использованием тяжелой техники, а также — на подземные шахты.
Из добытой руды металлы извлекаются, как правило, с помощью химического или электролитического восстановления. В пирометаллургии для преобразования руды в металлическое сырьё используются высокие температуры, в гидрометаллургии применяют для тех же целей водную химию. Используемые методы зависят от вида металла и типа загрязнения.
Когда металлическая руда является ионным соединением металла и неметалла, для извлечения чистого металла она обычно подвергается выплавлению — нагреву с восстановителем. Многие распространенные металлы, такие как железо, плавят с использованием в качестве восстановителя углерода (получаемого из сжигания угля). Некоторые металлы, такие как алюминий и натрий, не имеют ни одного экономически оправданного восстановителя и извлекаются с применением электролиза. [4] [5]
Сульфидные руды не улучшаются непосредственно до получения чистого металла, но обжигаются на воздухе, с целью преобразования их в окислы.
Свойства металлов
Характерные свойства металлов
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки (см.: пластичность; однако некоторые металлы, например германий и висмут, непластичны)
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Твёрдость некоторых металлов по шкале Мооса: [6]
| Твёрдость | Металл |
|---|---|
| 0.2 | Цезий |
| 0.3 | Рубидий |
| 0.4 | Калий |
| 0.5 | Натрий |
| 0.6 | Литий |
| 1.2 | Индий |
| 1.2 | Таллий |
| 1.25 | Барий |
| 1.5 | Стронций |
| 1.5 | Галлий |
| 1.5 | Олово |
| 1.5 | Свинец |
| 1.5 | Ртуть(тв.) |
| 1.75 | Кальций |
| 2.0 | Кадмий |
| 2.25 | Висмут |
| 2.5 | Магний |
| 2.5 | Цинк |
| 2.5 | Лантан |
| 2.5 | Серебро |
| 2.5 | Золото |
| 2.59 | Иттрий |
| 2.75 | Алюминий |
| 3.0 | Медь |
| 3.0 | Сурьма |
| 3.0 | Торий |
| 3.17 | Скандий |
| 3.5 | Платина |
| 3.75 | Кобальт |
| 3.75 | Палладий |
| 3.75 | Цирконий |
| 4.0 | Железо |
| 4.0 | Никель |
| 4.0 | Гафний |
| 4.0 | Марганец |
| 4.5 | Ванадий |
| 4.5 | Молибден |
| 4.5 | Родий |
| 4.5 | Титан |
| 4.75 | Ниобий |
| 5.0 | Иридий |
| 5.0 | Рутений |
| 5.0 | Тантал |
| 5.0 | Технеций |
| 5.0 | Хром |
| 5.5 | Бериллий |
| 5.5 | Осмий |
| 5.5 | Рений |
| 6.0 | Вольфрам |
| 6.0 | β-Уран |
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Гладкая поверхность металлов отражает большой процент света — это явление называется металлическим блеском. Однако в порошкообразном состоянии большинство металлов теряют свой блеск; алюминий и магний, тем не менее, сохраняют свой блеск и в порошке. Наиболее хорошо отражают свет алюминий, серебро и палладий — из этих металлов изготовляют зеркала. Для изготовления зеркал иногда применяется и родий, несмотря на его исключительно высокую цену: благодаря значительно большей, чем у серебра или даже палладия, твёрдости и химической стойкости, родиевый слой может быть значительно тоньше, чем серебряный.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
 Взаимодействие кислот с металлами
Взаимодействие кислот с металлами
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Происходит реакция замещения, которая также является окислительно-восстановительной:
 Взаимодействие серной кислоты H2SO4 с металлами
Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
 Реакции для азотной кислоты (HNO3)
Реакции для азотной кислоты (HNO3)


Продукты взаимодействия железа с HNO3 разной концентрации
 Легирование
Легирование
Легирование — это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного материала.
Микроскопическое строение
Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, т. е. течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
Некоторые металлы






Применение металлов
Конструкционные материалы
Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы
Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
История развития представлений о металлах
Знакомство человека с металлами началось с золота, серебра и меди, то есть с металлов, встречающихся в свободном состоянии на земной поверхности; впоследствии к ним присоединились металлы, значительно распространенные в природе и легко выделяемые из их соединений: олово, свинец, железо и ртуть. Эти семь металлов были знакомы человечеству в глубокой древности. Среди древнеегипетских артефактов встречаются золотые и медные изделия, которые, по некоторым данным, относятся к эпохе, удаленной на 3000—4000 лет от н. э.
К семи известным металлам уже только в средние века прибавились цинк, висмут, сурьма и в начале XVIII столетия мышьяк. С середины XVIII века число открытых металлов быстро возрастает и к началу XX столетия доходит до 65, а к началу XXI века — до 96.
Ни одно из химических производств не способствовало столько развитию химических знаний, как процессы, связанные с получением и обработкой металлов; с историей их связаны важнейшие моменты истории химии. Свойства металлов так характерны, что уже в самую раннюю эпоху золото, серебро, медь, свинец, олово, железо и ртуть составляли одну естественную группу однородных веществ, и понятие о «металле» относится к древнейшим химическим понятиям. Однако воззрения на их натуру в более или менее определенной форме появляются только в средние века у алхимиков. Правда, идеи Аристотеля о природе: образовании всего существующего из четырёх элементов (огня, земли, воды и воздуха) уже тем самым указывали на сложность металлов; но эти идеи были слишком туманны и абстрактны. У алхимиков понятие о сложности металлов и, как результат этого, вера в возможность превращать одни металлы в другие, создавать их искусственно, является основным понятием их миросозерцания. Это понятие есть естественный вывод из той массы фактов, относящихся до химических превращений металлов, которые накопились к тому времени. В самом деле, превращение металла в совершенно непохожую на них окись простым прокаливанием на воздухе и обратное получение металла из окиси, выделение одних металлов из других, образование сплавов, обладающих другими свойствами, чем первоначально взятые металлы, и прочее — всё это как будто должно было указывать на сложность их натуры.
Что касается собственно до превращения металлов в золото, то вера в возможность этого была основана на многих видимых фактах. В первое время образование сплавов, цветом похожих на золото, например из меди и цинка, в глазах алхимиков уже было превращением их в золото. Им казалось, что нужно изменить только цвет, и свойства металла также станут другими. В особенности много способствовали этой вере плохо поставленные опыты, когда для превращения неблагородного металла в золото брались вещества, содержавшие примесь этого золота. Например, уже в конце XVIII столетия один копенгагенский аптекарь уверял, что химически чистое серебро при сплавлении с мышьяком отчасти превращается в золото. Этот факт был подтвержден известным химиком Гитоном де Морво и наделал много шума. Вскорости потом было показано, что мышьяк, служивший для опыта, содержал следы серебра с золотом.
Так как из семи известных тогда металлов одни легче подвергались химическим превращениям, другие труднее, то алхимики делили их на благородные — совершенные, и неблагородные — несовершенные. К первым принадлежали золото и серебро, ко вторым медь, олово, свинец, железо и ртуть. Последняя, обладая свойствами благородных металлов, но в то же время резко отличаясь от всех металлов своим жидким состоянием и летучестью, чрезвычайно занимала тогдашних ученых, и некоторые выделяли её в особую группу; внимание, привлекавшееся ей, было так велико, что ртуть стали считать в числе элементов, из которых образованы собственно металлы, и в ней именно видели носителя металлических свойств. Принимая существование в природе перехода одних металлов в другие, несовершенных в совершенные, алхимики предполагали, что в обычных условиях это превращение идет чрезвычайно медленно, целыми веками, и, может быть, не без таинственного участия небесных светил, которым в тогдашнее время приписывали такую большую роль и в судьбе человека. По совпадению, известных тогда металлов было семь, как и известных тогда планет, а это ещё более указывало на таинственную связь между ними. У алхимиков металлы часто носят название планет; золото называется Солнцем, серебро — Луной, медь — Венерой, олово — Юпитером, свинец — Сатурном, железо — Марсом и ртуть — Меркурием. Когда были открыты цинк, висмут, сурьма и мышьяк, тела, во всех отношениях схожие с металлами, но у которых одно из характернейших свойств металла, ковкость, развито в слабой степени, то они были выделены в особую группу — полуметаллов. Деление металлов на собственно металлы и полуметаллы существовало ещё в середине XVIII столетия.
Определение состава металла первоначально было чисто умозрительным. В первое время алхимики принимали, что они образованы из двух элементов — ртути и серы. Происхождение этого воззрения неизвестно, оно имеется уже в VIII столетии. По Геберу доказательством присутствия ртути в металлах служит то, что она их растворяет, и в этих растворах индивидуальность их исчезает, поглощается ртутью, чего не случилось бы, если бы в них не было одного общего с ртутью начала. Кроме того, ртуть со свинцом давала нечто похожее на олово. Что касается серы, то, может быть, она взята потому, что были известны сернистые соединения, по внешнему виду схожие с металлами. В дальнейшем эти простые представления, вероятно, вследствие безуспешных попыток получения металлов искусственно, крайне усложняются, запутываются. В понятиях алхимиков, например Х—XIII столетий, ртуть и сера, из которых образованы металлы, не были теми ртутью и серой, которые имели в руках алхимики. Это было только нечто схожее с ними, обладающее особыми свойствами; нечто такое, которое в обыкновенной сере и ртути существовало реально, было выражено в них в большей степени, чем в других телах. Под ртутью, входящей в состав металлов, представляли нечто, обуславливающее неизменяемость их, металлический блеск, тягучесть, одним словом, носителя металлического вида; под серой подразумевали носителя изменяемости, разлагаемости, горючести металлов. Эти два элемента находились в металлах в различном соотношении и, как тогда говорили, различным образом фиксированные; кроме того, они могли быть различной степени чистоты. По Геберу, например, золото состояло из большого количества ртути и небольшого количества серы в высшей степени чистоты и наиболее фиксированных; в олове, напротив, предполагали много серы и мало ртути, которые были не чисты, плохо фиксированы и прочее. Всем этим, конечно, хотели выразить различное отношение металлов к единственному в тогдашнее время могущественному химическому агенту — огню. При дальнейшем развитии этих воззрений двух элементов — ртути и серы — для объяснения состава металлов алхимикам показалось недостаточно; к ним присоединили соль, а некоторые мышьяк. Этим хотели указать, что при всех превращениях металлов остается нечто не летучее, постоянное. Если в природе «превращение неблагородных металлов в благородные совершается веками», то алхимики стремились создать такие условия, в которых этот процесс совершенствования, созревания шёл бы скоро и легко. Вследствие тесной связи химии с тогдашней медициной и тогдашней биологией, идея о превращении металлов естественным образом отождествлялась с идеей о росте и развитии организованных тел: переход, например, свинца в золото, образование растения из зерна, брошенного в землю и как бы разложившегося, брожение, исцеление больного органа у человека — все это были частные явления одного общего таинственного жизненного процесса, совершенствования, и вызывались одними стимулами. Отсюда само собой понятно, что таинственное начало, дающее возможность получить золото, должно было исцелять болезни, превращать старое человеческое тело в молодое и прочее. Так сложилось понятие о чудесном философском камне.
Что касается роли философского камня в превращении неблагородных металлов в благородные, то больше всего существует указаний относительно перехода их в золото, о получении серебра говорится мало. По одним авторам, один и тот же философский камень превращает металлы в серебро и золото; по другим — существуют два рода этого вещества: одно совершенное, другое менее совершенное, и это то последнее и служит для получения серебра. Относительно количества философского камня, требующегося для превращения, указания тоже разные. По одним, 1 часть его способна превратить в золото 10000000 частей металла, по другим — 100 частей и даже только 2 части. Для получения золота плавили какой-нибудь неблагородный металл или брали ртуть и бросали туда философский камень; одни уверяли, что превращение происходит мгновенно, другие же — мало-помалу. Эти взгляды на природу металлов и на способность их к превращениям держатся в общем в течение многих веков до XVII столетия, когда начинают резко отрицать все это, тем более что эти взгляды вызвали появление многих шарлатанов, эксплуатировавших надежду легковерных получить золото. С идеями алхимиков в особенности боролся Бойль: «Я бы хотел знать, — говорит он в одном месте, — как можно разложить золото на ртуть, серу и соль; я готов уплатить издержки по этому опыту; что касается меня, то я никогда не мог этого достигнуть».
После вековых бесплодных попыток искусственного получения металлов и при том количестве фактов, которые накопились к XVII столетию, например о роли воздуха при горении, увеличении веса металла при окислении, что, впрочем, знал ещё Гебер в VIII столетии, вопрос об элементарности состава металла, казалось, был совсем близок к окончанию; но в химии появилось новое течение, результатом которого явилась флогистонная теория, и решение этого вопроса было ещё отсрочено на продолжительное время.
Тогдашних ученых сильно занимали явления горения. Исходя из основной идеи тогдашней философии, что сходство в свойствах тел должно происходить от одинаковости начал, элементов, входящих в их состав, принимали, что тела горючие заключают общий элемент. Акт горения считался актом разложения, распадения на элементы; при этом элемент горючести выделялся в виде пламени, а другие оставались. Признавая взгляд алхимиков на образование металлов из трёх элементов, ртути, серы и соли, и принимая их реальное существование в металле, горючим началом в них нужно было признать серу. Тогда другой составной частью металла нужно было, очевидно, признать остаток от прокаливания металла — «землю», как тогда говорили; следовательно, ртуть тут ни при чём. С другой стороны, сера сгорает в серную кислоту, которую многие, в силу сказанного, считали более простым телом, чем сера, и включили в число элементарных тел. Выходила путаница и противоречие. Бехер, чтобы согласовать старые понятия с новыми, принимал существование в металле земли трех сортов: собственно «землю», «землю горючую» и «землю ртутную». В этих-то условиях Шталь предложил свою теорию. По его мнению, началом горючести служит не сера и не какое-либо другое известное вещество, а нечто неизвестное, названное им флогистоном. Металлы, будто бы, образованы из флогистона и земли; прокаливание металла на воздухе сопровождается выделением флогистона; обратное получение металлов из его земли с помощью угля — вещества, богатого флогистоном — есть акт соединения флогистона с землей. Хотя металлов было несколько и каждый из них при прокаливании давал свою землю, последняя, как элемент, была одна, так что и эта составная часть металла была такого же гипотетического характера, как и флогистон; впрочем, последователи Шталя иногда принимали столько «элементарных земель», сколько было металлов. Когда Кавендиш при растворении металлов в кислотах получил водород и исследовал его свойства (неспособность поддерживать горение, его взрывчатость в смеси с воздухом и проч.), он признал в нём флогистон Шталя; металлы, по его понятиям, состоят из водорода и «земли». Этот взгляд принимался многими последователями флогистонной теории.
Несмотря на видимую стройность теории флогистона, существовали крупные факты, которые никак нельзя было связать с ней. Ещё Геберу было известно, что металлы при обжигании увеличиваются в весе; между тем, по Шталю, они должны терять флогистон: при обратном присоединении флогистона к «земле» вес полученного металла меньше веса «земли». Таким образом выходило, что флогистон должен обладать каким-то особенным свойством — отрицательным тяготением. Несмотря на все остроумные гипотезы, высказанные для объяснения этого явления, оно было непонятно и вызывало недоумение.
Когда Лавуазье выяснил роль воздуха при горении и показал, что прибыль в весе металлов при обжигании происходит от присоединения к металлам кислорода из воздуха, и таким образом установил, что акт горения металлов есть не распадение на элементы, а, напротив, акт соединения, вопрос о сложности металлов был решен отрицательно. Металлы были отнесены к простым химическим элементам, в силу основной идеи Лавуазье, что простые тела суть те, из которых не удалось выделить других тел. С созданием периодической системы химических элементов Менделеевым элементы металлов заняли в ней своё законное место.
См. также
Примечания
- ↑Международный химический союз признал 112-й химический элемент
- ↑ Этимологический словарь русского языка. Вып. 10: М / Под общей редакцией А. Ф. Журавлёва и Н. М. Шанского. — М.: Изд-во МГУ, 2007. — 400 с. ISBN 978-5-211-05375-5
- ↑ Юрий Кукшкин. Химия вокруг нас
- ↑ (англ.) Los Alamos National Laboratory – Sodium. Архивировано из первоисточника 4 августа 2012.
- ↑ (англ.) Los Alamos National Laboratory – Aluminum. Архивировано из первоисточника 4 августа 2012.
- ↑Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
4Al+3O2=Al2O3
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Источник https://extxe.com/16319/metally-svojstva-harakteristiki-metallov/
Источник https://dic.academic.ru/dic.nsf/ruwiki/8322
Источник https://obrazovaka.ru/himiya/metally-formula-9-klass.html
