Роль тяжелых металлов в экосфере
Среди загрязнителей биосферы, представляющих наибольший интерес для различных служб контроля ее качества, металлы (в первую очередь тяжелые, то есть имеющие атомный вес больше 40) относятся к числу важнейших. В значительной мере это связано с биологической активностью многих из них.
ВВЕДЕНИЕ
Среди загрязнителей биосферы, представляющих наибольший интерес для различных служб контроля ее качества, металлы (в первую очередь тяжелые, то есть имеющие атомный вес больше 40) относятся к числу важнейших. В значительной мере это связано с биологической активностью многих из них. На организм человека и животных физиологическое действие металлов различно и зависит от природы металла, типа соединения, в котором он существует в природной среде, а также его концентрации. Многие тяжелые металлы проявляют выраженные комплексообразующие свойства. Так, в водных средах ионы этих металлов гидратированы и способны образовывать различные гидроксокомплексы, состав которых зависит от кислотности раствора. Если в растворе присутствуют какие-либо анионы или молекулы органических соединений, то ионы этих металлов образуют разнообразные комплексы различного строения и устойчивости. В ряду тяжелых металлов одни крайне необходимы для жизнеобеспечения человека и других живых организмов и относятся к так называемым биогенным элементам. Другие вызывают противоположный эффект и, попадая в живой организм, приводят к его отравлению или гибели. Эти металлы относят к классу ксенобиотиков, то есть чуждых живому. Специалистами по охране окружающей среды среди металлов-токсикантов выделена приоритетная группа. В нее входят кадмий, медь, мышьяк, никель, ртуть, свинец, цинк и хром как наиболее опасные для здоровья человека и животных. Из них ртуть, свинец и кадмий наиболее токсичны. К возможным источникам загрязнения биосферы тяжелыми металлами относят предприятия черной и цветной металлургии (аэрозольные выбросы, загрязняющие атмосферу, промышленные стоки, загрязняющие поверхностные воды), машиностроения (гальванические ванны меднения, никелирования, хромирования, кадмирования), заводы по переработке аккумуляторных батарей, автомобильный транспорт. Кроме антропогенных источников загрязнения среды обитания тяжелыми металлами существуют и другие, естественные, например вулканические извержения: кадмий обнаружили сравнительно недавно в продуктах извержения вулкана Этна на острове Сицилия в Средиземном море. Увеличение концентрации металлов-токсикантов в поверхностных водах некоторых озер может происходить в результате кислотных дождей, приводящих к растворению минералов и пород, омываемых этими озерами. Все эти источники загрязнения вызывают в биосфере или ее составляющих (воздухе, воде, почвах, живых организмах) увеличение содержания металлов-загрязнителей по сравнению с естественным, так называемым фоновым уровнем. Хотя, как было упомянуто выше, попадание металла-токсиканта может происходить и путем аэрозольного переноса, в основном они проникают в живой организм через воду. Попав в организм, металлы-токсиканты чаще всего не подвергаются каким-либо существенным превращениям, как это происходит с органическими токсикантами, и, включившись в биохимический цикл, они крайне медленно покидают его. Для контроля качества поверхностных вод созданы различные гидробиологические службы наблюдений. Они следят за состоянием загрязнения водных экосистем под влиянием антропогенного воздействия. Поскольку такая экосистема включает в себя как саму среду (воду), так и другие компоненты (донные отложения и живые организмы — гидробионты), сведения о распределении тяжелых металлов между отдельными компонентами экосистемы имеют весьма важное значение. Надежные данные в этом случае могут быть получены при использовании современных методов аналитической химии, позволяющих определить содержание тяжелых металлов на уровне фоновых концентраций. Нужно отметить, что успехи в развитии методов анализа позволили решить такие глобальные проблемы, как обнаружение основных источников загрязнения биосферы, установление динамики загрязнения и трансформации загрязнителей, их перенос и миграцию. При этом тяжелые металлы были классифицированы как одни из важнейших объектов анализа. Поскольку их содержание в природных материалах может колебаться в широких пределах, то и методы их определения должны обеспечивать решение поставленной задачи. В результате усилий ученых-аналитиков многих стран были разработаны методы, позволяющие определять тяжелые металлы на уровне фемтограммов (10-15 г) или в присутствии в анализируемом объеме пробы одного (!) атома, например никеля в живой клетке.
К сложной и многогранной проблеме, которую представляют собой химические загрязнения окружающей среды тяжелыми металлами и которая охватывает различные дисциплины и уже превратилась в самостоятельную междисциплинарную область знаний, профессиональный интерес проявляют не только химики-аналитики, биологи и экологи (их деятельность традиционно связана с этой проблемой), но и медики. В потоке научной и научно-популярной информации, а также в средствах массовой информации все чаще появляются материалы о влиянии тяжелых металлов на состояние здоровья человека. Так, в США обратили внимание на проявление агрессивности у детей в связи с повышенным содержанием в их организме свинца. В других регионах планеты рост числа правонарушений и самоубийств также связывают с повышением содержания этих токсикантов в окружающей среде. Представляет интерес обсуждение некоторых химических и эколого-химических аспектов проблемы распространения тяжелых металлов в окружающей среде.
1. ТЯЖЕЛЫЕ МЕТАЛЛЫ В БИОСФЕРЕ
К тяжелым металлам относятся более 40 химических элементов периодической системы с атомной массой свыше 50 а. е. м. Иногда тяжелыми металлами называют элементы, которые имеют плотность более 7 – 8 тыс. кг/м³ (кроме благородных и редких). Группа элементов, обозначаемых ТМ , активно участвует в биологический процессах, многие из них входит в состав ферментов. Набор тяжелых металлов во многом совпадает с перечнем микроэлементов. Большинство микроэлементов выполняет в живых организмах функции инициаторов и активаторов биохимических процессов. Районы, в которых концентрация химических элементов в силу природных причин оказывается выше или ниже фонового уровня называют биохимическими провинциями. Формирование биохимических провинций обусловлено особенностями почвообразующих пород, почвообразовательного процесса, а так же присутствием рудных аномалий. При загрязнении биосферы происходит образование техногенных аномалий, в которых содержание элементов превышает в 10 раз и более фоновое. К числу тяжелых металлов относят хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, молибден, кадмий, олово, сурьму, теллур, вольфрам, ртуть, таллий, свинец, висмут. Главными природными источниками тяжелых металлов являются породы (магматические и осадочные) и породообразующие минералы. Многие минералы в виде высокодисперсных частиц включаются в качестве микропримеси в массу горных пород. Например минералы титана (брукит, ильменит). Породообразующие минералы содержат так же рассеянные элементы в качестве изоморфных примесей в структуре металлических решёток , замещая макроэлементы с близким размером радиуса. Например, К на Sr, Pb, B; Na – Cd, Mn, Cr, Bi; Mg – Ni, Co, Zn, Sb, Sn, Pb, Mn; Fe – Cd, Mn, Sr, Bi. В последние десятилетия в процессы миграции ТМ в природной среде интенсивно включилась антропогенная деятельность человечества. Количества химических элементов, поступающие в окружающую среду в результате техногенеза, в ряде случаев значительно превосходят уровень их естественного поступления. Например, глобальное выделение Pb из природных источников в год составляет 12 тыс.т. и антропогенная эмиссия 332 тыс.т. По приведенным ниже данным можно судить о размерах антропогенной деятельности человечества: вклад техногенного свинца составляет 94-97% (остальное — природные источники), кадмия — 84-89%, меди — 56-87%, никеля — 66-75%, ртути — 58% и т.д. При этом 26-44% мирового антропогенного потока этих элементов приходится на Европу, а на долю европейской территории бывшего СССР — 28-42% от всех выбросов в Европе (Вронский, 1996). Ниже приводим краткое описание свойств металлов, касающихся особенностей их поведения в почвах.
2. ФОРМЫ СУЩЕСТВОВАНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ В ПОВЕРХНОСТНЫХ ВОДАХ
Важнейшим показателем качества среды обитания является степень чистоты поверхностных вод. Металл-токсикант, попав в водоем или реку, распределяется между компонентами этой водной экосистемы. Однако не всякое количество металла вызывает расстройство данной системы. При оценке способности экосистемы сопротивляться внешнему токсическому воздействию принято говорить о буферной емкости экосистемы. Так, под буферной емкостью пресноводных экосистем по отношению к тяжелым металлам понимают такое количество металла-токсиканта, поступление которого существенно не нарушает естественного характера функционирования всей изучаемой экосистемы. При этом сам металл-токсикант распределяется на следующие составляющие: 1) металл в растворенной форме; 2) сорбированный и аккумулированный фитопланктоном, то есть растительными микроорганизмами; 3) удерживаемый донными отложениями в результате седиментации взвешенных органических и минеральных частиц из водной среды; 4) адсорбированный на поверхности донных отложений непосредственно из водной среды в растворимой форме; 5) находящийся в адсорбированной форме на частицах взвеси.
На формы нахождения металлов в водах оказывают влияние гидробионты (например, моллюски). Так, при изучении поведения меди в поверхностных водах наблюдают сезонные колебания ее концентрации: в зимний период они максимальны, а летом вследствие активного роста биомассы снижаются. При осаждении взвешенных органических частиц, которые обладают способностью адсорбировать ионы меди, последние переходят в донные отложения, что и приводит к наблюдаемому эффекту. Следует также отметить, что интенсивность этого процесса зависит от скорости седиментации взвесей, то есть косвенно от таких факторов, как размеры и заряд адсорбирующих ионы меди частиц. Кроме аккумулирования металлов за счет адсорбции и последующей седиментации в поверхностных водах происходят другие процессы, отражающие устойчивость экосистем к токсическому воздействию такого рода загрязнителей. Наиболее важный из них состоит в связывании ионов металлов в водной среде растворенными органическими веществами. При этом общая концентрация токсиканта в воде не меняется. Тем не менее принято считать, что наибольшей токсичностью обладают гидратированные ионы металлов, а связанные в комплексы опасны в меньшей мере либо даже почти безвредны. Специальные исследования показали, что между общей концентрацией металла-токсиканта в природных поверхностных водах и их токсичностью нет однозначной зависимости. В природных поверхностных водах содержится множество органических веществ, 80% которых составляют высокоокисленные полимеры типа гумусовых веществ, проникающих в воду из почв. Остальная часть органических веществ, растворимых в воде, представляет собой продукты жизнедеятельности организмов (полипептиды, полисахариды, жирные и аминокислоты) или же подобные по химическим свойствам примеси антропогенного происхождения. Все они, конечно, претерпевают различные превращения в водной среде. Но все они в то же время являются своего рода комплексообразующими реагентами, связывающими ионы металлов в комплексы и уменьшающими тем самым токсичность вод. Различные поверхностные воды по-разному связывают ионы металлов-токсикантов, проявляя при этом различную буферную емкость. Воды южных озер, рек, водоемов, имеющих большой набор природных компонентов (гумусовые вещества, гуминовые кислоты и фульвокислоты) и их высокую концентрацию, способны к более эффективной природной детоксикации по сравнению с водами водоемов Севера и умеренной полосы. Таким образом, при прочих равных условиях токсичность вод, в которых оказались загрязнители, зависит и от климатических условий природной зоны. Следует отметить, что буферная емкость поверхностных вод по отношению к металлам-токсикантам определяется не только наличием растворенного органического вещества и взвесей, но и аккумулирующей способностью гидробионтов, а также кинетикой поглощения ионов металлов всеми компонентами экосистемы, включая комплексообразование с растворенными органическими веществами. Все это говорит о сложности процессов, протекающих в поверхностных водах при попадании в них металлов-загрязнителей. Интересно отметить, что гуминовые кислоты, эти специфические природные высокомолекулярные соединения, образующиеся при превращении растительных остатков в почвах под влиянием микроорганизмов, способны, видимо, в наибольшей степени связывать ионы тяжелых металлов в прочные комплексы. Так, константы устойчивости соответствующих гуматов (комплексов ионов тяжелых металлов с гуминовыми кислотами) имеют значения в пределах 105-1012 в зависимости от природы металла. Устойчивость гуматов зависит от кислотности водной среды.
Химико-аналитический аспект проблемы определения форм существования металлов в природных водах хотя и был сформулирован около 20 лет назад, однако лишь с появлением новейших методов анализа эта задача стала доступной для решения. Раньше определяли лишь валовое содержание тяжелого металла в воде и устанавливали распределение между взвешенной и растворенной формами. О качестве вод, загрязненных металлами, судили на основе сопоставления данных по их валовому содержанию с величинами ПДК. Сейчас такая оценка считается неполной и необоснованной, так как биологическое действие металла определяется его состоянием в водах, а это, как правило, комплексы с различными компонентами. Как уже отмечалось выше, в отдельных случаях, например при комплексообразовании с органическими соединениями естественного происхождения, эти комплексы не только малотоксичны, но нередко оказывают стимулирующее действие на развитие гидробионтов, поскольку при этом они становятся биологически доступны организмам. При разработке существующих ПДК процессы комплексообразования не учитывали и оценку влияния неорганических солей тяжелых металлов на живые организмы проводили в чистых водных растворах при отсутствии растворенных органических веществ естественного происхождения. Строго говоря, провести такую оценку сложно, а порой и невозможно. Итак, токсичность вод при загрязнении их тяжелыми металлами в основном определяется концентрацией либо акваионов металлов, либо простейших комплексов с неорганическими ионами. Присутствие других комплексообразующих веществ, и прежде всего органических, понижает токсичность. Отмеченное выше явление накопления токсикантов в донных отложениях может явиться причиной вторичной токсичности вод. Действительно, даже если источник загрязнения устранен и, как говорят, «вода пошла нормальная», в дальнейшем становится возможна обратная миграция металла из донных отложений в воды. Прогнозирование состояния водных систем должно опираться поэтому на данные анализа всех их составляющих, проводимого через определенные промежутки времени. Любопытным оказался случай обнаружения залежей киновари (сульфида ртути) в одном из районов Карпат. Для геологов эта находка стала неожиданностью. Оказалось, что в средние века в селениях, расположенных в горах выше по течению реки, систематически применяли препарат ртути для лечения некоторых заболеваний. Шли годы, река собирала этот металл, переносила его вниз по течению и аккумулировала в одной из природных ловушек в виде донных отложений. Дальнейшая его трансформация дала в итоге киноварь.
3. ТЯЖЕЛЫЕ МЕТАЛЛЫ КАК ТОКСИКАНТЫ В ПРИРОДНЫХ ВОДАХ
Из перечня приоритетных металлов-загрязнителей рассмотрим ртуть, свинец и кадмий как представляющие наибольшую опасность для здоровья человека и животных. Ртуть. В окружающей среде соединения ртути с различной степенью окисления металла, то есть Hg(0), Hg(I), Hg(II), могут реагировать между собой. Наибольшую опасность представляют собой органические, прежде всего алкильные, соединения. Самый емкий аккумулятор соединений ртути (до 97%) — поверхностные воды океанов. Около половины всей ртути в природную среду попадает по техногенным причинам. Кислотность среды и ее окислительный потенциал влияют на нахождение в водной среде той или иной формы ртути. Так, в хорошо аэрированных водоемах преобладают соединения Hg(II). Ионы ртути легко связываются в прочные комплексы с различными органическими веществами, находящимися в водах и выступающими в качестве лигандов. Особенно прочные комплексы образуются с серосодержащими соединениями. Ртуть легко адсорбируется на взвешенных частицах вод. При этом так называемый фактор концентрирования достигает порой 105, то есть на этих частицах сконцентрировано ртути в сто тысяч раз больше, чем находится в равновесии в водной среде. Отсюда следует, что судьба металла будет определяться сорбцией взвешенными частицами с последующей седиментацией, то есть по существу будет происходить удаление ртути из водной системы, как это уже было описано на примере образования залежей киновари в регионе Карпат. Следует отметить, что десорбция ртути из донных отложений происходит медленно, поэтому повторное загрязнение поверхностных вод после того, как источник загрязнения установлен и ликвидирован, также имеет заторможенную кинетику.
В водных средах ртуть образует металлорганические соединения типа R-Hg-X и R-Hg-R, где R — метил- или этил-радикал. Из антропогенных источников в водные системы ртуть попадает в виде преимущественно металлической ртути, ионов Hg(II) и ацетата фенилртути. Преобладающей формой ртути, обнаруживаемой в рыбе, является метилртуть, образующаяся биологическим путем с участием ферментов микроорганизмов. В незагрязненных поверхностных водах содержание ртути колеблется в пределах 0,2-0,1 мкг/л, в морских — в три раза меньше. Водные растения поглощают ртуть. Органические соединения R-Hg-R’ в пресноводном планктоне содержатся в большей концентрации, чем в морском. Из организма органические соединения ртути выводятся медленнее, чем неорганические. Существующий стандарт на предельное содержание этого токсиканта (0,5 мкг/кг) используют при контроле качества пищевых продуктов. При этом предполагают, что ртуть присутствует в виде метилированных соединений. При попадании в организм человека последних может проявиться болезнь Минимата. Свинец. Половина от общего количества этого токсиканта поступает в окружающую среду в результате сжигания этилированного бензина. В водных системах свинец в основном связан адсорбционно со взвешенными частицами или находится в виде растворимых комплексов с гуминовыми кислотами. При биометилировании, как и в случае с ртутью, свинец в итоге образует тетраметилсвинец. В незагрязненных поверхностных водах суши содержание свинца обычно не превышает 3 мкг/л. В реках промышленных регионов отмечается более высокое содержание свинца. Снег способен в значительной степени аккумулировать этот токсикант: в окрестностях крупных городов его содержание может достигать почти 1 млн мкг/л, а на некотором удалении от них ~1-100 мкг/л. Водные растения хорошо аккумулируют свинец, но по-разному. Иногда фитопланктон удерживает его с коэффициентом концентрирования до 105, как и ртуть. В рыбе свинец накапливается незначительно, поэтому для человека в этом звене трофической цепи он относительно мало опасен. Метилированные соединения в рыбе в обычных условиях содержания водоемов обнаруживаются относительно редко. В регионах с промышленными выбросами накопление тетраметилсвинца в тканях рыб протекает эффективно и быстро — острое и хроническое воздействие свинца наступает при уровне загрязненности 0,1-0,5 мкг/л. В организме человека свинец может накапливаться в скелете, замещая кальций. Кадмий. По химическим свойствам этот металл подобен цинку. Он может замещать последний в активных центрах металлсодержащих ферментов, приводя к резкому нарушению в функционировании ферментативных процессов. В рудных месторождениях кадмий, как правило, присутствует вместе с цинком. В водных системах кадмий связывается с растворенными органическими веществами, особенно если в их структуре присутствует сульфгидрильные группы SH. Кадмий образует также комплексы с аминокислотами, полисахаридами, гуминовыми кислотами. Считают, однако, что само по себе присутствие высоких концентраций этих лигандов, способных связывать кадмий, еще недостаточно для понижения концентрации свободных акваионов кадмия до уровня, безопасного для живых организмов. Адсорбция ионов кадмия донными осадками сильно зависит от кислотности среды. В нейтральных водных средах свободный ион кадмия практически нацело сорбируется частицами донных отложений. Источников поступления кадмия в окружающую среду еще несколько лет назад было достаточно много. После того как была доказана его высокая токсичность, их число резко сократилось (по крайней мере в промышленно развитых странах). Сейчас основной источник загрязнения окружающей среды этим токсикантом — места захоронения никель-кадмиевых аккумуляторов. Как уже отмечалось, кадмий обнаружен в продуктах извержения вулкана Этна. В дождевой воде концентрация кадмия может превышать 50 мкг/л. В пресноводных водоемах и реках содержание кадмия колеблется в пределах 20-400 нг/л. Наименьшее его содержание в океане зарегистрировано в акватории Тихого океана, к востоку от Японских островов (~ 0,8-9,6 нг/л на глубине 8-5500 м). Этот металл накапливается водными растениями и в тканях внутренних органов рыб (но не в скелетной мускулатуре).
Кадмий обычно проявляет меньшую токсичность по отношению к растениям в сравнении с метилртутью и сопоставим по токсичности со свинцом. При содержании кадмия ~ 0,2-1 мг/л замедляются фотосинтез и рост растений. Интересен следующий зафиксированный эффект: токсичность кадмия заметно снижается в присутствии некоторых количеств цинка, что еще раз подтверждает предположение о возможности конкуренции ионов этих металлов в организме за участие в ферментативном процессе. Порог острой токсичности кадмия варьирует в пределах от 0,09 до 105 мкг/л для пресноводных рыб. Увеличение жесткости воды повышает степень защиты организма от отравления кадмием. Известны случаи сильного отравления людей кадмием, попавшим в организм по трофическим цепям (болезнь итай-итай). Из организма кадмий выводится в течение длительного периода (около 30 лет).
4. ТЯЖЕЛЫЕ МЕТАЛЛЫ В ПОЧВАХ
- преобразование оксидов тяжелых металлов в гидроксиды (карбонаты, гидрокарбонаты);
- растворение гидроксидов тяжелых металлов и адсорбция соответствующих катионов ТМ твердыми фазами почв;
- образование фосфатов тяжелых металлов и их соединений с органическими веществами почвы.
Тяжелые металлы, поступающие на поверхность почвы, накапливаются в почвенной толще, особенно в верхнем горизонте и медленно удаляются при выщелачивании, потреблением растениями и эрозии. Первый период полуудаления ТМ значительно варьируется для разных элементов: Zn – 70 – 510 лет, Cd – 13 – 110 лет, Cu – 310 – 1500 лет, Pb – 740 – 5900 лет.
Свинец (Pb). Атомная масса 207,2. Приоритетный элемент-токсикант. Все растворимые соединения свинца ядовиты. В естественных условиях он существует в основном в форме PbS. Кларк Pb в земной коре 16,0 мг/кг. По сравнению с другими ТМ он наименее подвижен, причем степень подвижности элемента сильно снижается при известковании почв. Подвижный Pb присутствует в виде комплексов с органическим веществом. При высоких значениях рН свинец закрепляется в почве химически в виде гидроксида, фосфата, карбоната и Pb-органических комплексов.
Естественное содержание свинца в почвах наследуется от материнских пород и тесно связано с их минералогическим и химическим составом. Средняя концентрация этого элемента в почвах мира достигает по разным оценка от 10 до 35 мг/кг. ПДК свинца для почв в России соответствует 30 мг/кг, в Германии — 100 мг/кг.
Высокая концентрация свинца в почвах может быть связана как с природными геохимическими аномалиями, так и с антропогенным воздействием. При техногенном загрязнении наибольшая концентрация элемента, как правило, обнаруживается в верхнем слое почвы. В некоторых промышленных районах она достигает 1000 мг/кг, а в поверхностном слое почв вокруг предприятий цветной металлургии в Западной Европе – 545 мг/кг.
Содержание свинца в почвах на территории России существенно варьирует в зависимости от типа почвы, близости промышленных предприятий и естественных геохимических аномалий. В почвах селитебных зон, особенно связанных с использованием и производством свинецсодержащих продуктов, содержание данного элемента часто в десятки и более раз превышает ПДК. По предварительным оценкам до 28% территории страны имеет содержание Рb в почве, в среднем, ниже фоновой, а 11% — могут быть отнесены к зоне риска. В то же время, в Российской Федерации проблема загрязнения почв свинцом — преимущественно проблема селитебных территорий .
Кадмий (Cd). Атомная масса 112,4. Кадмий по химическим свойствам близок к цинку, но отличается от него большей подвижностью в кислых средах и лучшей доступностью для растений. В почвенном растворе металл присутствует в виде Cd2+ и образовывает комплексные ионы и органические хелаты. Главный фактор, определяющий содержание элемента в почвах при отсутствии антропогенного влияния, – материнские породы. Кларк кадмия в литосфере 0,13 мг/кг. В почвообразующих породах содержание металла в среднем составляет: в глинах и глинистых сланцах – 0,15 мг/кг, лессах и лессовидных суглинках – 0,08, песках и супесях – 0,03 мг/кг. В четвертичных отложениях Западной Сибири концентрация кадмия изменяется в пределах 0,01-0,08 мг/кг.
Подвижность кадмия в почве зависит от среды и окислительно-восстановительного потенциала.
Среднее содержание кадмия в почвах мира равно 0,5 мг/кг. Концентрация его в почвенном покрове европейской части России составляет 0,14 мг/кг – в дерново-подзолистой почве, 0,24 мг/кг – в черноземе, 0,07 мг/кг – в основных типах почв Западной Сибири. Ориентировочно-допустимое содержание (ОДК) кадмия для песчаных и супесчаных почв в России составляет 0,5 мг/кг, в Германии ПДК кадмия — 3 мг/кг.
Загрязнение почвенного покрова кадмием считается одним из наиболее опасных экологических явлений, так как он накапливается в растениях выше нормы даже при слабом загрязнении почвы. Наибольшие концентрации кадмия в верхнем слое почв отмечаются в горнорудных районах – до 469 мг/кг, вокруг цинкоплавилен они достигают 1700 мг/кг.
Цинк (Zn). Атомная масса 65,4. Его кларк в земной коре 83 мг/кг. Цинк концентрируется в глинистых отложениях и сланцах в количествах от 80 до 120 мг/кг, в делювиальных, лессовидных и карбонатных суглинистых отложениях Урала, в суглинках Западной Сибири – от 60 до 80 мг/кг.
Среднее содержание цинка в почвах мира составляет 90 мг/кг. Концентрация его в почвенном покрове европейской территории равна 32-60 мг/кг, в почвах Западной Сибири – 60-81 мг/кг.
Причинами повышенного содержания цинка в почвах могут быть как естественные геохимические аномалии, так и техногенное загрязнение. Основными антропогенными источниками его поступления в первую очередь являются предприятия цветной металлургии. Загрязнение почв этим металлом привело в некоторых областях к крайне высокой его аккумуляции в верхнем слое почв – до 66400 мг/кг. В огородных почвах накапливается до 250 и более мг/кг цинка. ОДК цинка для песчаных и супесчаных почв равна 55 мг/кг, германскими учеными рекомендуется ПДК, равная 100 мг/кг.
Медь (Cu). Атомная масса 63,5. Кларк в земной коре 47 мг/кг (Виноградов, 1962). В химическом отношении медь – малоактивный металл. Основополагающим фактором, влияющим на величину содержания Cu, является концентрация ее в почвообразующих породах. Из изверженных пород наибольшее количество элемента накапливают основные породы — базальты (100-140 мг/кг) и андезиты (20-30 мг/кг). Покровные и лессовидные суглинки (20-40 мг/кг) менее богаты медью. Наименьшее же ее содержание отмечается в песчаниках, известняках и гранитах (5-15 мг/кг). Концентрация метала в глинах европейской части территории бывшего СССР достигает 25 мг/кг, в лессовидных суглинках – 18 мг/кг. Супесчаные и песчаные почвообразующие породы Горного Алтая накапливают в среднем 31 мг/кг меди, юга Западной Сибири – 19 мг/кг.
В почвах медь является слабомиграционным элементом, хотя содержание подвижной формы бывает достаточно высоким. Количество подвижной меди зависит от многих факторов: химического и минералогического состава материнской породы, рН почвенного раствора, содержания органического вещества и др. Наибольшее количество меди в почве связано с оксидами железа, марганца, гидроксидами железа и алюминия и, особенно, с монтмориллонитом вермикулитом. Гуминовые и фульвокислоты способны образовывать устойчивые комплексы с медью. При рН 7-8 растворимость меди наименьшая.
Среднее содержание меди в почвах мира 30 мг/кг. Вблизи индустриальных источников загрязнения в некоторых случаях может наблюдаться загрязнение почвы медью до 3500 мг/кг. Среднее содержание металла в почвах центральных и южных областей бывшего СССР составляет 4,5-10,0 мг/кг, юга Западной Сибири – 30,6 мг/кг, Сибири и Дальнего Востока – 27,8 мг/кг. ПДК меди в России – 55 мг/кг, ОДК для песчаных и супесчаных почв – 33 мг/кг, в ФРГ – 100 мг/кг.
Никель (Ni). Атомная масса 58,7. В континентальных отложениях он присутствует, главным образом, в виде сульфидов и арсенитов, ассоциируется также с карбонатами, фосфатами и силикатами. Кларк элемента в земной коре равен 58 мг/кг. Наибольшее количество металла накапливают ультраосновные (1400-2000 мг/кг) и основные (200-1000 мг/кг) породы, а осадочные и кислые содержат его в гораздо меньших концентрациях – 5-90 и 5-15 мг/кг, соответственно. Большое значение в накоплении никеля почвообразующими породами играет их гранулометрический состав. На примере почвообразующих пород Западной Сибири видно, что в более легких породах его содержание наименьшее, в тяжелых – наибольшее: в песках – 17, супесях и легких суглинки –22, средние суглинки – 36, тяжелые суглинки и глины –49.
Содержание никеля в почвах в значительной степени зависит от обеспеченности этим элементом почвообразующих пород. Наибольшие концентрации никеля, как правило, наблюдаются в глинистых и суглинистых почвах, в почвах, сформированных на основных и вулканических породах и богатых органическим веществом. Распределение Ni в почвенном профиле определяется содержанием органического вещества, аморфных оксидов и количеством глинистой фракции.
Содержание Ni в почвах мира колеблется в широких пределах – от 1 до 100 мг/кг, составляя в среднем 50 мг/кг. Концентрация никеля в почвах европейской части России составляет – 51-54 мг/кг, Западной Сибири – 37-41 мг/кг.
Уровень концентрации никеля в верхнем слое почв зависит также от степени их техногенного загрязнения. В районах с развитой металлообрабатывающей промышленностью в почвах встречается очень высокое накопление никеля: в Канаде его валовое содержание достигает 206-26000 мг/кг, а в Великобритании содержание подвижных форм доходит до 506-600 мг/кг. В почвах Великобритании, Голландии, ФРГ, обработанных осадками сточных вод никель накапливается до 84-101 мг/кг. В России (по данным обследования 40-60 % почв сельскохозяйственных угодий) этим элементом загрязнены 2,8 % почвенного покрова. Доля загрязненных Ni почв в ряду других ТМ (Pb, Cd, Zn, Cr, Co, As и др.), является фактически самой значительной и уступает только землям загрязненным медью (3,8%). По данным мониторинга земель Государственной станции агрохимической службы «Бурятская» за 1993-1997 гг. на территории Республики Бурятия зарегистрировано превышение ПДК никеля на 1,4 % земель от обследованной территории сельхозугодий, среди которых выделяются почвы Закаменского (загрязнены 20% земель — 46 тыс.га) и Хоринского районов (загрязнены 11% земель – 8 тыс.га).
Содержание никеля в почвах России ограничивается следующими нормативами: ПДК никеля в почвах – 85 мг/кг; ОДК для песчаных и супесчаных почв – 20; ОДК обменной формы – 4,0 мг/кг. В Германии безопасным содержанием валового никеля в почвах считается 80-200 мг/кг.
Хром (Cr). Атомная масса 52. В природных соединениях хром обладает валентностью +3 и +6. Большая часть Cr3+ присутствует в хромите FeCr2O4 или других минералах шпинелевого ряда, где он замещает Fe и Al, к которым очень близок по своим геохимическим свойствам и ионному радиусу.
Кларк хрома в земной коре – 83 мг/кг. Наибольшие его концентрации среди магматических горных пород характерны для ультраосновных и основных (1600-3400 и 170-200 мг/кг соответственно), меньшие – для средних пород (15-50 мг/кг) и наименьшие – для кислых (4-25 мг/кг). Среди осадочных пород максимальное содержание элемента обнаружено в глинистых осадках и сланцах (60-120 мг/кг), минимальное – в песчаниках и известняках (5-40 мг/кг). Содержание металла в почвообразующих породах разных регионов весьма разнообразно. В европейской части бывшего СССР его содержание в таких наиболее распространенных почвообразующих породах, как лессы, лессовидные карбонатные и покровные суглинки, составляет в среднем 75-95 мг/кг. Почвообразующие породы Западной Сибири содержат в среднем 58 мг/кг Cr, причем его количество тесно связано с гранулометрическим составом пород: песчаные и супесчаные породы — 16 мг/кг, а среднесуглинистые и глинистые – около 60 мг/кг.
В почвах большая часть хрома присутствует в виде Cr3+. В кислой среде ион Cr3+ инертен, при рН 5,5 почти полностью выпадает в осадок. Ион Cr6+ крайне не стабилен и легко мобилизуется как в кислых, так и щелочных почвах. Адсорбция хрома глинами зависит от рН среды: при увеличении рН адсорбция Cr6+ уменьшается, а Cr3+ увеличивается. Органическое вещество почвы стимулирует восстановление Cr6+ до Cr3+.
Природное содержание хрома в почвах зависит главным образом от его концентрации в почвообразующих породах, а распределение по почвенному профилю – от особенностей почвообразования, в частности от гранулометрического состава генетических горизонтов. Среднее содержание хрома в почвах – 70 мг/кг. Наибольшее содержание элемента отмечается в почвах, сформированных на богатых этим металлом основных и вулканических породах. Среднее содержание Cr в почвах США составляет 54 мг/кг, Китая – 150 мг/кг, Украины – 400 мг/кг. В России его высокие концентрации в почвах в естественных условиях обусловлены обогащенностью почвообразующих пород. Курские черноземы содержат 83 мг/кг хрома, дерново-подзолистые почвы Московской области – 100 мг/кг. В почвах Урала, сформированных на серпентинитах, металла содержится до 10000 мг/кг, Западной Сибири – 86 – 115 мг/кг.
Вклад антропогенных источников в поступление хрома весьма значителен. Металлический хром в основном используется для хромирования в качестве компонента легированных сталей. Загрязнение почв Cr отмечено за счет выбросов цементных заводов, отвалов железохромовых шлаков, нефтеперегонных заводов, предприятий черной и цветной металлургии, использования в сельском хозяйстве осадков промышленных сточных вод, особенно кожевенных предприятий, и минеральных удобрений. Наивысшие концентрации хрома в техногенно загрязненных почвах достигают 400 и более мг/кг, что особенно характерно крупным городам. В Бурятии по данным мониторинга земель, проведенным Государственной станцией агрохимической службы «Бурятская» за 1993-1997 гг., хромом загрязнены 22 тыс. га. Превышения ПДК в 1,6-1,8 раз отмечены в Джидинском (6,2 тыс. га), Закаменском (17,0 тыс. га) и Тункинском (14,0 тыс. га) районах. ПДК хрома в почвах в России еще не разработаны, а в Германии для почв сельскохозяйственных угодий она составляет 200-500, приусадебных участков – 100 мг/кг.
5. ВЛИЯНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ НА МИКРОБНЫЙ ЦЕНОЗ ПОЧВ
Одним из наиболее эффективно диагностирующих индикаторов загрязнения почв является ее биологическое состояние, которое можно оценить по жизнеспособности населяющих ее почвенных микроорганизмов.
Следует также учитывать, что микроорганизмы играют большую роль и в миграции ТМ в почве. В процессе жизнедеятельности они выступают в роли продуцентов, потребителей и транспортирующих агентов в почвенной экосистеме. Многие почвенные грибы проявляют способность к иммобилизации ТМ, закрепляя их в мицелии и временно, исключая из круговорота. Кроме того, грибы, выделяя органические кислоты, нейтрализуют действие этих элементов, образуя с ними компоненты, менее токсичные и доступные для растений, чем свободные ионы.
Под влиянием повышенных концентраций ТМ наблюдается резкое снижение активности ферментов: амилазы, дегидрогеназы, уреазы, инвертазы, каталазы, а также численности отдельных агрономически ценных групп микроорганизмов. ТМ ингибируют процессы минерализации и синтеза различных веществ в почвах, подавляют дыхание почвенных микроорганизмов, вызывают микробостатический эффект, могут выступать как мутагенный фактор. При избыточном содержании ТМ в почве снижается активность метаболических процессов, происходят морфологические трансформации в строении репродуктивных органов и другие изменения почвенной биоты. ТМ в значительной степени могут подавлять биохимическую активность и вызывать изменения общей численности почвенных микроорганизмов.
Загрязнение почв ТМ вызывает определенные изменения в видовом составе комплекса почвенных микроорганизмов. В качестве общей закономерности отмечается значительное сокращение видового богатства и разнообразия комплекса почвенных микромицетов при загрязнении. В микробном сообществе загрязненной почвы появляются необычные для нормальных условий, устойчивые к ТМ виды микромицетов. Толерантность микроорганизмов к загрязнению почвы зависит от их принадлежности к различным систематическим группам. Очень чувствительны к высоким концентрациям ТМ виды рода Bacillus, нитрифицирующие микроорганизмы, несколько более устойчивы – псевдомонады, стрептомицеты и многие виды целлюлозоразрушающих микроорганизмов, наиболее же устойчивы – грибы и актиномицеты.
При низких концентрациях ТМ наблюдается некоторая стимуляция развития микробного сообщества, затем по мере возрастания концентраций происходит частичное ингибирование и, наконец, полное его подавление. Достоверные изменения видового состава фиксируются при концентрациях ТМ в 50-300 раз выше фоновых.
Степень угнетения жизнедеятельности микробоценоза зависит также от физиолого-биохимических свойств конкретных металлов, загрязняющих почвы. Свинец отрицательно влияет на биотическую деятельность в почве, ингибируя активность ферментов уменьшением интенсивности выделения двуокиси углерода и численности микроорганизмов, вызывает нарушения метаболизма микроорганизмов, особенно процессов дыхания и клеточного деления. Ионы кадмия в концентрации 12 мг/кг нарушают фиксацию атмосферного азота, а также процессы аммонификации, нитрификации и денитрификации. Наиболее подвержены воздействию кадмия грибы, причем некоторые виды после попадания металла в почву полностью исчезают. Избыток цинка в почвах затрудняет ферментацию разложения целлюлозы, дыхание микроорганизмов, действие уреазы и т. д., вследствие чего нарушаются процессы преобразования органического вещества в почвах. Кроме того, токсичное влияние ТМ зависит от набора металлов и их взаимного воздействия (антагонистического, синергичного или суммарного) на микробиоту.
Таким образом, под влиянием загрязнения почв ТМ происходят изменения в комплексе почвенных микроорганизмов. Это выражается в снижении видового богатства и разнообразия и увеличения доли толерантных к загрязнению микроорганизмов.
От активности почвенных процессов и жизнедеятельности населяющих ее микроорганизмов зависит интенсивность самоочищения почвы от загрязнителей.
Уровень загрязнения почв ТМ влияет на показатели биохимической активности почв, видовую структуру и общую численность микробоценоза. В почвах, где содержание тяжелых металлов превышает фоновое в 2-5 и более раз, наиболее заметно изменяются отдельные показатели ферментативной активности, несколько возрастает суммарная биомасса амилолитического микробного сообщества, изменяются и другие микробиологические показатели. При дальнейшем увеличении содержания ТМ до одного порядка обнаруживается достоверное снижение отдельных показателей биохимической активности почвенных микроорганизмов. Происходит перераспределение доминирования в почве амилолитического микробного сообщества. В почве, содержащей ТМ в концентрациях на один-два порядка превышающих фоновые, достоверны изменения уже целой группы микробиологических показателей. Сокращается число видов почвенных микромицетов, и наиболее устойчивые виды начинают абсолютно доминировать. При превышении содержания ТМ в почве над фоном на три порядка наблюдаются резкие изменения практически всех микробиологических показателей. При указанных концентрациях ТМ в почвах происходит ингибирование и гибель нормальной для незагрязненной почвы микробиоты. В то же время активно развивается и даже абсолютно доминирует очень ограниченное число микроорганизмов, резистентных к ТМ, преимущественно микромицетов. Наконец, при концентрациях ТМ в почвах, превышающих фоновые на четыре и более порядков, обнаруживается катастрофическое снижение микробиологической активности почв, граничащее с полной гибелью микроорганизмов.
6. ТЯЖЕЛЫЕ МЕТАЛЛЫ В РАСТЕНИЯХ
Растительная пища является основным источником поступления ТМ в организм человека и животных. По разным данным, с ней поступает от 40 до 80 % ТМ, и только 20-40 % — с воздухом и водой. Поэтому от уровня накопления металлов в растениях, используемых в пищу, в значительной степени зависит здоровье населения.
Химический состав растений, как известно, отражает элементный состав почв. Поэтому избыточное накопление ТМ растениями обусловлено, прежде всего, их высокими концентрациями в почвах. В своей жизнедеятельности растения контактируют только с доступными формами ТМ, количество которых, в свою очередь, тесно связано с буферностью почв. Однако, способность почв связывать и инактивировать ТМ имеет свои пределы, и когда они уже не справляются с поступающим потоком металлов, важное значение приобретает наличие у самих растений физиолого-биохимических механизмов, препятствующих их поступлению.
Механизмы устойчивости растений к избытку ТМ могут проявляться по разным направлениям: одни виды способны накапливать высокие концентрации ТМ, но проявлять к ним толерантность; другие стремятся снизить их поступление путем максимального использования своих барьерных функций. Для большинства растений первым барьерным уровнем являются корни, где задерживается наибольшее количество ТМ, следующий – стебли и листья, и, наконец, последний – органы и части растений, отвечающие за воспроизводительные функции (чаще всего семена и плоды, а также корне- и клубнеплоды и др.)
Однако не всегда эти закономерности повторяются, что, вероятно, связано с условиями произрастания растений и их генетической спецификой. Отмечаются случаи, когда разные сорта одной культуры, произрастающие на одинаково загрязненной почве содержали различное количество ТМ. Данный факт, по-видимому, обусловлен присущим всем живым организмам внутривидовым полиморфизмом, способным проявить себя и при техногенном загрязнении природной среды. Это свойство у растений может стать основой генетико-селекционных исследований с целью создания сортов с повышенными защитными возможностями по отношению к избыточным концентрациям ТМ.
Несмотря на существенную изменчивость различных растений к накоплению ТМ, биоаккумуляция элементов имеет определенную тенденцию, позволяющую упорядочить их в несколько групп: 1) Cd, Cs, Rb – элементы интенсивного поглощения; 2) Zn, Mo, Cu, Pb, As, Co – средней степени поглощения; 3) Mn, Ni, Cr – слабого поглощения и 4) Se, Fe, Ba, Te – элементы, труднодоступные растениям.
Другой путь поступления ТМ в растения – некорневое поглощение из воздушных потоков. Оно имеет место при значительном выпадении металлов из атмосферы на листовой аппарат, чаще всего вблизи крупных промышленных предприятий. Поступление элементов в растения через листья (или фолиарное поглощение) происходит, главным образом, путем неметаболического проникновения через кутикулу. ТМ, поглощенные листьями, могут переносится в другие органы и ткани и включаться в обмен веществ. Не представляют опасности для человека металлы, осаждающиеся с пылевыми выбросами на листьях и стеблях, если перед употреблением в пищу растения тщательно промываются. Однако животные, поедающие такую растительность, могут получить большое количество ТМ.
По мере роста растений элементы перераспределяются по их органам. При этом для меди и цинка устанавливается следующая закономерность в их содержанию: корни > зерно > солома. Для свинца, кадмия и стронция она имеет другой вид: корни > солома > зерно. Известно, что наряду с видовой специфичностью растений в отношении накопления ТМ существуют и определенные общие закономерности. Например, наиболее высокое содержание ТМ обнаружено в листовых овощах и силосных культурах, а наименьшее – в бобовых, злаковых и технических культурах.
ЗАКЛЮЧЕНИЕ
Биосферу можно рассматривать как обобщенный объект анализа. На практике специалист той или иной области науки имеет дело с какой-либо одной составной его частью. Однако каждый конкретный объект находится в постоянной динамике, во взаимной связи с другими объектами и поэтому меняет не только свой состав, но и свойства. Порой эти изменения невелики, чтобы их можно было заметить, нужен некоторый период времени, в течение которого эти изменения произойдут. Однако используемые методы наблюдения, то есть биомониторинг, должны быть и чувствительными, и точными. Сложность окружающей среды как объекта анализа, ее изменчивость заставляют периодически проводить ревизию данных, совершенствовать и методы определения, и отдельные этапы анализа. Недавно такую ревизию провели в отношении данных по распространенности ртути и меди в окружающей среде. Оказалось, что ранее этапы пробоотбора и пробоподготовки были недостаточно совершенны и включали в себя систематическую ошибку. Ее учет в итоге привел к тому, что данные по содержанию ртути в отдельных объектах окружающей среды были завышены порой на порядок. Хотя прогноз по содержанию ртути в атмосферных выбросах на период до 2025 года предполагает удвоение количеств этого токсиканта, уже сейчас установлено, что в действительности ее концентрация меньше почти на порядок. Подобный же критический анализ данных ожидается и по оценке содержания меди.
СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ
- Алексеев Ю.В. Тяжелые металлы в почвах и растениях. Л.: 1987. 365 с.
- Ковда В.А. Биогеохимия почвенного покрова. М.: Наука. 1985. 243 с.
- Орлов Л.С. Экология и охрана биосферы при химическом загрязнении. М.: Высшая школа, 2002. 334 с.
- Тяжелые металлы в окружающей среде. М.: МГУ, 1980. 167 с.
Опубликовано:
19.08.2021
Вся экология:
- Начало
- Эко новости
- Популярные новости
- Новости сегодня
- Новости вчера
- Новости за день
- Архив экологических новостей
- Добавить материал
- RSS лента новостей
- Эко календарь
- Добавить событие
- Эко Законы
- Эко организации
- Эко сайты
- Добавить сайт
- Эко библиотека
- Составы отходов
- Словарь
- Книги по экологии
- Рефераты
- Эко объявления
- Контакты
- Наши баннеры
- Подписка
- Реклама на сайте







Авторские права на материалы принадлежат Всероссийскому Экологическому порталу, за исключением тех, где указан автор или источник. При полном или частичном цитировании всех материалов активная гиперссылка на Всероссийский Экологический портал (ecoportal.su) обязательна.
На сайте могут быть опубликованы материалы интернет-ресурсов «Facebook» и «Instagram», запрещённые на территории Российской Федерации.
Мнение редакции может не совпадать с мнением авторов новостных и других материалов, публикуемых на сайте. Сайт, для обеспечения работоспособности, использует файлы cookie. Продолжая пользоваться сайтом, вы соглашаетесь с их использованием.
Все предложения по работе сайта отправляйте на электронный ящик, опубликованный в разделе контакты.
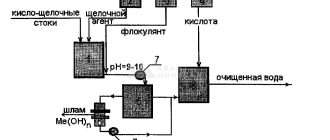
Природные и антропогенные источники тяжелых металлов
Главный источник тяжелых металлов – промышленность. Выбросы проникают в водоемы, атмосферу, почву, а из нее – в сельхозкультуры. Самые токсичные – свинец, ртуть, мышьяк, кадмий и хром.
Ртуть
Ртути присвоен I класс опасности. Ее естественное состояние в земной коре – безвредные сульфидные остатки, но вследствие атмосферных процессов возникло загрязнение мирового океана. В нем было обнаружено 50 млн. т ртути. Если 5 000 т/год – естественный вынос, то еще столько же – результат деятельности человека.
В мире создается свыше 10 000 т ртути в год. В океане ртуть под воздействием анаэробов превращается в метилртуть и диметилртуть, опасные для всего живого. Метилртуть с кровью поступает в мозг, разрушая его, проникает в плаценту. При проглатывании и вдыхании паров металлической ртути чернеют и крошатся зубы. Ртутные соли просачиваются сквозь кожу, разъедая ее и слизистые.

Свинец
Свинцу присвоен I классу опасности. Он выделяется при выплавке из руды. Каждый год в мире используется до 180 000 т свинца, а наибольшее загрязнение наблюдается на автомобильных выхлопных газах. При движении машины в атмосферу выбрасывается свинец содержащийся в бензине. Основная масса оседает на землю, но часть остается в воздухе.
Читайте также: 6,6 из 10: экологический рейтинг городов России
Еще свинцовая пыль покрывает почву в промышленных зонах. Другие источники загрязнения – угольные электростанции и бытовые печи, глиняная посуда с глазурью, красящие пигменты.
Неорганические соединения свинца расстраивают метаболизм, металл может замещать кальций в костях. Органические еще более токсичны.
Кадмий и цинк
1 млн. кг кадмия ежегодно выбрасывается в атмосферу вследствие его выплавки. Это 45% общего загрязнения. Другие 55% – следствие сжигания или переработки кадмийсодержащих изделий. Заводы по выплавке цинка – крупнейшие источники загрязнения данным металлом. Оба элемента проникают в водоемы, попадают в рыбу, скапливаются в печени и почках.
Значительные загрязнения цинком обнаруживаются вблизи автомагистралей. Источником загрязнения кадмием также являются удобрения. Элемент внедряется в растения, используемые в пищу, и отравляет организм. При этом кадмий намного токсичнее цинка, ему присвоен I класс опасности. Вдыхание воздуха, в котором его больше 5 мг/м3, в течение 8 ч. чревато смертью.
Сурьма, мышьяк, кобальт
Каждый год в мире производится около 70 т сурьмы. Она входит в состав сплавов, применяется для изготовления спичек, а в чистом виде идет на полупроводники. Хроническое отравление нарушает функции ЖКТ.
У мышьяка II класс опасности, он летучий и легко попадает в воздух. Сильнейшие источники загрязнения – гербициды, фунгициды и инсектициды. Элементарный мышьяк – слабый яд, но нарушает развитие плода. Отравление вызывает болезни ЦНС, изменения печени, атрофию костного мозга.
Кобальт задействуют в сталелитейном деле, изготовлении полимеров. Это элемент I класса опасности.
Медь и марганец
Медь относится ко II классу опасности. По воде и воздуху металл переносится на огромные расстояния. Аномальным содержание меди в почвах и растениях остается на расстоянии больше 8 км от плавильного завода. Ее излишки откладываются в тканях мозга, коже, печени, поджелудочной. Она провоцирует болезнь Вильсона.
У марганца тоже II класс опасности. Источники загрязнения – производства легированной стали, сплавов, электробатарей. Превышение нормы марганца в воздухе разрушает ЦНС.
Тяжелые металлы-загрязнители окружающей среды
Тяжёлых металлов из таблицы Менделеева насчитывается около 40. Но чаще всего главными загрязнителями окружающей среды становятся лишь некоторые из них.
Ртуть
Около половины количества содержания ртути попадает в экосистему по техногенным причинам. Вместе со сточными водами и атмосферными выбросами предприятий нефтехимии соединения ртути оказываются в окружающей среде. Подавляющее количество — около 97% — находится на поверхности мирового океана. Соединения ртути, обладающие разной степенью окисления, в природе вступают в реакции между собой. Самыми опасными являются органические (алкильные) соединения ртути — метилртуть и диметилртуть. Находясь в воде, эти соединения адсорбируются донными отложениями, а затем медленно высвобождаются, становясь источником вторичного загрязнения и хронического токсического поражения гидросферы.
Нехватка чистой пресной воды – глобальная проблема человечества
Загрязнение воды, как экологическая проблема номер один на планете
Читайте также: Влияние загрязнений на живые организмы.. Загрязнение окружающей среды Многие экологические проблемы, существующие сегодня, являются следствием неразумной. — презентация
Вторичное загрязнение водоёмов как процесс, приводящий к деградации водных объектов
Кадмий
Кадмий — высокотоксичный тяжёлый металл. Он обладает довольно большой летучестью, поэтому значительная его часть загрязняет атмосферу. Это происходит в результате работы заводов по его выплавке и гальванических производств. В почву кадмий проникает из сельхозудобрений, а также с нефтепродуктами. В результате атмосферных процессов он выпадает на землю и поверхностные воды в виде осадков, которые угнетают рост и развитие растений и оказывают канцерогенное действие на представителей животного мира.
Тяжелые металлы – наиболее опасные элементы, способные загрязнять почву
Возможно ли решение современных экологических проблем в глобальном масштабе
Свинец
Такой тяжёлый металл, как свинец, относится к 1 классу токсичной опасности. Среди промышленных отравлений именно отравление свинцом занимает первое место. Основными поставщиками свинцовых загрязнений на почву и в атмосферу являются выхлопы от сжигания этилированного бензина, выбросы промышленных предприятий, выпускающих пластик, целлюлозно-бумажные изделия, смазки, пигменты и другие.
Машиностроение в России и его вредные производства, влияющие на экологию
Влияние основных отраслей производства на экологию
Воздействие легкой промышленности и ее текстильной отрасли на окружающую среду
Свинец способен накапливаться в биомассе, образуя высокотоксичные соединения. Далее соединения свинца вмешиваются в метаболический цикл растений и животных. Так, следуя по пищевым цепочкам, токсические элементы попадают в организм человека.
Читайте также: Чем улучшить истощенную почву
Вы знали, что соединения свинца способны разрушить структуру ДНК и причинить существенный вред репродуктивной системе человека?
Медь
В окружающую среду медь попадает из выбросов отходов металлургических предприятий, заводов по изготовлению химических источников тока (аккумуляторов, батареек), сельхозхимии. Когда ионы меди попадают в почву, то они быстро связываются с минералами и органическими веществами.
Основные источники загрязнения литосферы и возможные последствия
С помощью каких мер можно защитить почву от загрязнения?
Химическое загрязнение почвы
Попав в воду, медь распространяется на дальние расстояния, загрязняя всё новые акватории. Этот тяжёлый металл не разрушается в природе, и поэтому он накапливается в растениях, микроорганизмах. Большие дозы меди в организме человека разрушают его репродуктивную систему, органы ЦНС.
Цинк
На повышение содержания цинка могут повлиять как естественные геохимические процессы, так и техногенное загрязнение предприятиями цветной металлургии и химической промышленности.
Из вышеперечисленных тяжёлых металлов цинк наименее токсичен, однако, существенное превышение его доз аккумулируется в верхних слоях почвы, загрязняя плодородный слой.
Попав в организм человека, цинк заметно активирует деятельность ферментов. Превышенная доза цинка может вызвать рвоту.
Молибден
Молибден попадает в окружающую среду из минеральных удобрений и из выбросов предприятий по добыче и переработке молибденовых руд. Примечательно, что в некоторых регионах страны фиксируется недостаток молибдена в биосфере. А в регионах, где базируются крупные предприятия, добывающие и перерабатывающие молибденовые руды, его содержание в почве и воде может превышать норму в 100-200 раз. Растения, накапливающие данный металл в аномальных количествах, становятся ядовитыми для человека и животных. Повышенное содержание молибдена в организме человека вызывает угнетение функций гипофиза, гипоталамуса, щитовидной железы.
Загрязнение почвы тяжелыми металлами
Самые долгие последствия вызывает загрязнение почв тяжелыми металлами вследствие добычи, плавки руд, промышленных выбросов, применения удобрений. Особенно опасны кадмий, медь, свинец, цинк, поскольку они стойкие, биоаккумулятивные и токсичные.
Последствия загрязнения почвы
Из-за загрязнения почв металлами ухудшается рост и метаболизм почвенных микробов. Это может затруднить поглощение растениями питательных веществ из почвы. Плюс тяжелые металлы токсичны для растений. Все это приводят к замедлению роста, низкой урожайности.
Растения, накопившие токсиканты, могут поступать в пищу. Это опасно для здоровья. Еще они из почвы проникают в питьевую воду, вызывая болезни.
Рекультивация земель, загрязненных тяжелыми металлами
Перед рекультивацией земель, загрязненных тяжелыми металлами, важно выявить источник загрязнения, реализовать меры по его ликвидации и уменьшению выбросов. Только так достигается эффективность работ.
Рекультивация земельных участков проводится несколькими способами:
- Выращивание устойчивых к загрязнению растений (колосовые зерновые, капуста, картофель, хлопчатник, свекла).
- Фиторекультивация растениями, накапливающими металлы.
- Контроль подвижности токсикантов в почве.
- Регулирование соотношения элементов в почве.
- Организация рекультивационного слоя.
Загрязнение водоемов тяжелыми металлами
Загрязнения нефтепродуктами и токсичными металлами ухудшают качество среды обитания водных биоресурсов. Они негативно влияют на кормовую базу рыб, выживаемость молоди и размножение взрослых особей.
Источники загрязнения водоемов – стоки горнодобывающих, металлургических заводов, химическая и легкая промышленность. Соли хрома сбрасывают фабрики по дублению кожи, хром с никелем используют для гальванического покрытия изделий из металла. Соединения цинка, кобальта, меди, титана – это красители.
Наибольшую опасность представляет загрязнение вод ртутью. При взаимодействии с микробами со дна образуются водорастворимые органические соединения высокой токсичности.
Некоторые металлы содержатся в пестицидах и удобрениях. Уровень загрязнения ими растет вследствие кислотных дождей, то есть закисления.
Предельно допустимые концентрации в воде
При оценке состояния экосистем учитывается загрязненность водных объектов токсичными веществами. Особенно опасны тяжелые металлы. Поэтому установлены их предельно допустимые концентрации, которые при ежедневном влиянии не допускают развития у людей патологий.
| Металл | ПДК в обычной воде | ПДК в рыбохозяйственных прудах |
| Ртуть | 0,5 мкг/л | до 0,1 мкг/л |
| Свинец | 0,03 мг/л | 0,1 мг/л |
| Кадмий | 1 мкг/л | до 0,5 мг/л |
| Кобальт | 0,1 мкг/л | 0,01 мг/л |
| Марганец | 0,1 мкг/л | 0,1 мкг/л |
| Мышьяк | 50 мкг/л | 50 мкг/л |
| Медь | 0,1 мкг/л | 0,001 мг/л |
Воздействие тяжелых металлов на наземные и почвенные экосистемы
Замечание 1
Тяжелые металлы являются представителями одной из приоритетных групп загрязнителей, являющихся причиной деградации окружающей среды. К ним относят более 40 элементов с атомной массой выше 50 а.е.м.
Читайте также: Лекция»Окружающая человека среда и ее компоненты» для студентов 1 курса колледжа
Как правило, основная масса тяжёлых металлов, поступающая в окружающую среду со временем аккумулируется почвой. Поступление металлов в почву сопровождается рядом физических, химических, биохимических, физико-химических и других взаимодействий, в ходе которых и происходит их аккумуляция, выщелачивание, осуществление межфазных переходов, а также поступление в растительные и животные организмы.
Следует отметить, что в ходе этих взаимодействий опасность металлов для живых организмов может существенно меняться. Для биоты наибольшую опасность тяжелые металлы представляют, когда они сконцентрированы в почвенном растворе. Поступление тяжелых металлов в экосистемы зачастую сопровождается их деградацией и даже полным разрушением. Однако чаще всего воздействие тяжелых металлов сопровождается следующими реакциями со стороны наземных экосистем:
Готовые работы на аналогичную тему
- Курсовая работа Влияние тяжелых металлов на экосистемы 420 руб.
- Реферат Влияние тяжелых металлов на экосистемы 240 руб.
- Контрольная работа Влияние тяжелых металлов на экосистемы 230 руб.
Получить выполненную работу или консультацию специалиста по вашему учебному проекту Узнать стоимость
- наблюдается ухудшение состояния биологической составляющей экосистем, проявляющееся в снижении видового разнообразия, а также объёмов общей биомассы и численности организмов; происходит осуществление процесса техногенной сукцессии, характеризующейся развитием биоценоза в сторону ее пионерных стадий;
- происходит снижение продуктивности экосистем;
- наблюдается процесс деградации почвенного покрова, сопровождающийся уменьшением запасов гумуса, а также ухудшением его качественного состава, увеличением почвенной кислотности, снижением биологической активности и др.;
- происходит снижение плодородных свойств и как следствие — уменьшение запаса доступных растениям форм биогенных элементов, сопровождающееся нарушением оптимального соотношения макро- и микроэлементов.
Действие тяжёлых металлов на почву путем вмешательства в биологические циклы происходит как прямо, так и опосредованно. При этом зачастую подвергается изменениям структура микробиологического сообщества и его состав, являющийся показателем видового разнообразия. Больше всего действию тяжелых металлов в микробоценозе подвержены нитрифицирующие и целлюлолитические бактерии. Их угнетение приводит к нарушению прохождения цикла азота в почве и процессов минерализации органического вещества.
Требуется вычитка, рецензия учебной работы? Задай вопрос преподавателю и получи ответ через 15 минут! Задать вопрос
Кроме косвенного тяжелые металлы оказывают ещё и прямое воздействие на почву и её характеристики. Так, например, имеется информация о консервации в загрязненных почвах органического вещества. Причиной тому является ограниченная доступность комплексов тяжелых металлов с гумусовыми кислотами для минерализации микроорганизмами.
Загрязнение атмосферы тяжелыми металлами
Техногенные выбросы металлов в виде аэрозолей поступают в атмосферу и переносятся на огромные расстояния, провоцируя глобальное загрязнение. С гидрохимическими стоками их часть попадает в бессточные водоемы, скапливается в воде и на дне. Это может вызвать вторичное загрязнение.
Металлы быстро распространяются в воде, выпадают в осадок в виде сульфатов и карбонатов и частично абсорбируются на органических осадках. При исчерпании абсорбционной способности осадков токсиканты проникают в воду, повышая ее кислотность, провоцируя зарастание водоемов и интенсивное выделение углекислого газа вследствие жизнедеятельности микроорганизмов.
Откуда берутся тяжелые металлы?
Породы магматического и осадочного происхождения
Основным природным источником загрязнения тяжелыми металлами являются разные породы магматического и осадочного происхождения. Многие минералы, содержащие эти элементы, могут быть примесями в другие горные породы. В эту группу входят: минералы хрома (Fe2Cr2O4) и титана (анатаз, ильменит, брусит). Соединения этой категории химических элементов могут попасть в атмосферу из космоса (с космической пылью), и из недр нашей планеты (с помощью вулканических газов).
Антропогенное загрязнение
Важным фактором поступления тяжелых металлов в окружающую среду является антропогенное загрязнение. Промышленность цемента, черная и цветная металлургия, из-за технологических процессов при большой температуре, выбрасывает очень большое количество этих элементов в нашу среду обитания. Эти загрязнители могут проникнуть и в наши продукты питания, если орошение полей проводилось водами содержащие большую концентрацию таких химических элементов (например, бытовые сточные воды). Это случается по мотиву, что одни из них считаются микроэлементами. Конечно, не только так эти металлы попадают в водоёмы. Если рядом с вашим местом обитания есть металлургические предприятия, рудники, или на ваши поля вносится большое количество минеральных удобрений с содержанием цинка, меди, железа, молибдена, то они могут попасть в подземные воды благодаря дождям, таянью снега. Так что я вам советую провести контроль качества воды на содержания в местности тяжелых металлов, если вы хотите выкопать колодец.
Не только локальная антропогенная активность может повлиять на вырастание содержания тяжелых металлов в атмосфере. В виде аэрозолей, эти химические элементы могут быть перенесены на многие десятки, сотни, да и тысячи километров от места их выброса в атмосферу. Также тяжелые элементы они могут накапливаться на дне бессточных водоемов в отложениях. Часть их содержания образуют нерастворимые карбонаты, сульфаты, а также входят в состав минеральных и органических осадков. Таким образом, содержание тяжелых металлов в отложених водоёмов растёт, но если отложения перенасыщены этими металлами, то они попадут назад в воду и тогда будет «двойной удар». Почему так? Да потому что, мы ещё не почувствовали глобально эффект от сильного загрязнения такими элементами. Вот когда, эти отложения со дна водоёмов утратят способность связывать их, то «вернут» части этих элементов назад в воду и тогда мы будем искать пригодную воду где-то в другом месте. Особо затруднительная ситуация создалась вблизи автострад. Там почва накопила столько свинца, кадмия и цинка что положительных прогнозов не ожидается.
Загрязнение пищевых продуктов тяжелыми металлами
Пищевые цепочки – один из основных путей поступления токсикантов в организм. Они начинаются от сельхозугодий и заканчиваются человеком. Растения поглощают металлы из почвы, в продукты животноводства они поступают через антибиотики, гормоны для стимуляции роста животных. Как конечное звено пищевой цепи, человек может получать еду с концентрация токсикантов до 1000 раз выше, чем в почвах.
Загрязнение пищевых продуктов происходит при готовке еды, контакте сырья с посудой во время термообработки. При консервировании жестяные банки становятся источником загрязнения свинцом. Он попадает в состав продуктов питания из свинцового припоя в швах.
Тяжелые металлы

Тяжелые металлы встречаются в природе и некоторые из них в небольших количествах необходимы для жизнедеятельности растений, животных, человека. Однако, их излишек пагубно влияет на окружающую среду и здоровье человека. Попадая в окружающую среду, те из них, что обладают высокой летучестью как, например, ртуть, переносятся по воздуху, другие, например, свинец и кадмий перемещаются на большие расстояния, перемешиваясь с пылью.
Интересно, что не все тяжелые металлы действительно являются «тяжелыми» в обычном понимании этого слова. Правильнее было бы называть их «токсичными металлами», но исторически сложилось так, что первые из изученных токсичных металлов действительно имели высокий удельный вес – свинец, кадмий и др. Позднее оказалось, что и многие «легкие» металлы обладают токсичностью, например, бериллий и литий, но по сложившейся привычке эту группу металлов продолжают называть «тяжелыми».
Источники загрязнения тяжелыми металлами — предприятия горнодобывающей и черной металлургии, машиностроительные заводы, гальванические цеха. Большой вклад в загрязнение окружающей среды тяжелыми металлами вносит цветная металлургия. Добыча, обогащение и выплавка цветных металлов и их сплавов наносят урон флоре и фауне прилегающим к промышленным предприятиям территорий.
Выброс отработанных вод в близрасположенные водоемы приводит к многочисленным заболеваниям их обитателей, особенно в тех случаях, когда сточные воды сбрасываются неочищенными, что было распространено в XX веке на территории СССР. Это привело к повышению уровня тяжелых металлов в биосистемах таких водоемов. До сих пор некоторые предприятия в Казахстане выбрасывают в атмосферу технологические газы без надлежащей очистки от пыли, которая является источником распространения тяжёлых металлов — меди, свинца, мышьяка и других вредных элементов. Это приводит к увеличению заболеваемости аллергией и астмой среди жителей близкорасположенных городов и сел.
Однако, не только промышленные предприятия являются источниками загрязнения окружающей среды тяжелыми металлами. Одним из основных источников выбросов в атмосферу вредного свинца является автотранспорт, работающий на этилированном бензине. Автотранспорт так же является основным источником выбросов других вредных веществ в городах, которые, в зависимости от загруженности городских дорог, составляют здесь 30 — 70 % от общего объема выбросов загрязняющих веществ в атмосферу.
Представляют опасность для окружающей среды и отработанные автомобильные аккумуляторы, и простые батарейки. Они после использования выбрасываются, их количество на коммунальных свалках исчисляется тысячами тонн. Когда они разлагаются, в почву и подземные воды попадает большое количество марганца, свинца, кадмия, лития и других токсичных металлов.
Кроме того, тяжелые металлы являются естественными примесями, входящими в состав исходного сырья для производства удобрений и пестицидов, и могут попадать в водоемы вместе со стоком с сельскохозяйственных полей и огородов.
В последнее время общественность всего мира уделяет большое внимание прекращению использования свинца в красках. Сегодня существует множество заменителей, которые позволяют сделать краску более безопасной, однако, производители продолжают использовать свинец. Не покупайте свинцовые белила и свинцовый сурик!
Встречаются тяжелые металлы и в товарах народного потребления, в том числе – в детских игрушках, причем, в концентрациях, значительно превышающих допустимые нормы. Так в 2012 году шесть организаций — участниц Международной сети по ликвидации СОЗ (IPEN), работающих в области здравоохранения и охраны окружающей среды в более, чем 100 странах мира, исследовали на токсичность 569 детских товаров, купленных наугад на рынках и в магазинах Армении, Беларуси, Казахстана, Кыргызстана, России и Украины. Товары исследовали на содержание сурьмы, мышьяка, кадмия, хрома, свинца и ртути.
В результате выяснилось, что в 164 из них в опасных концентрациях содержится хотя бы один токсичный элемент из шести. В 75 образцах их было более одного. Свинец был найден в 104 образцах, сурьма – в 75, мышьяк – в 45, ртуть – в 18. Среди опасных предметов оказались мягкие и пластмассовые игрушки, косметика, кружки, бижутерия.
Негативное воздействие тяжелых металлов связано с тем, что они способны «подменять» в организме полезные для жизнедеятельности необходимые металлы и инициировать нежелательные процессы. Например, некоторые металлы способствуют развитию раковых опухолей, кадмий и ртуть оказывают сильное токсическое действие на почки, свинец и ртуть пагубно влияют на нервную систему, кадмий и свинец аккумулируются в мужских половых органах и вызывают их дегенерацию и влияют на способность к деторождению. Кроме того, тяжелые металлы могут влиять на дыхательную и эндокринную систему, не говоря уже об их общетоксическом действии – тяжелое отравление этими веществами может привести к смерти.
Цинк
Цинк — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Цинк является важным элементом человеческого организма.
Еще в древнем Египте применялись мази на основе цинка, которые способствовали быстрому заживлению ран.
Польза цинка проявляется при ежедневной дозе в 5 — 20 мг в сочетании с другими микроэлементами и витаминами.
Вред цинка начинается со значительной передозировки металла в организме — 150 — 600 мг. — уже яд для человека, а 6 г. гарантируют летальный исход.
Основные источники отравления цинком:
Пары цинка образуются на производствах при сварке, резке металла и плавке цинковых спаев.
В быту цинк может попасть в организм из продуктов и воды, которые хранились в цинковой или оцинкованной посуде. Опасность представляют цинковые белила, которые при не соблюдении техники безопасности могут попасть в организм человека, так же белилами могут отравиться маленькие дети, которые так любят все пробовать на вкус.
Грибы способны интенсивно накапливать тяжелые металлы, которые обнаруживаются даже в экологически благоприятной окружающей среде. Можно представить, как влияет на их качество предприятия, транспорт, свалки. Больше всего цинк аккумулируется в белых грибах и сыроежках.
Симптомы отравления:
При ингаляционном отравлении окисью цинка — сладковатый вкус во рту. Спустя 1 — 5 ч. — чувство жажды, стеснения и давящей боли в груди, сухой кашель, сонливость, затем озноб и другие признаки металлической лихорадки.
При оральном отравлении растворимыми солями цинка: металлический вкус во рту, ожог слизистой ротовой полости, пищеварительного тракта, упорная рвота (с примесью крови), боли в животе, понос, судороги в икроножных мышцах.
Имеются указания на канцерогенное действие цинка и его соединений (в эксперименте при различных путях введения высокодисперсной пыли металлического цинка и раствора хлорида цинка через 1,5 — 2 года у животных развивались злокачественные опухоли различной локализации).
Меры предосторожности:
При работе на производстве где есть потенциальная опасность отравления, обязательно соблюдение техники безопасности и использования средств индивидуальной защиты.
В быту: не стоит использовать посуду, в состав которой входит цинк, для долговременного хранения продуктов и воды.
Стоит отказаться от красок и белил, содержащих цинк, тем более в доме, где есть дети.
Что же касается грибов: их потенциальная опасность — не повод совсем от них отказываться, но стоит более тщательно выбирать места их сбора. Чем дальше грибник находится от дорог и производств, тем более безопасны будут грибы.
Хром
Хром — твёрдый металл голубовато-белого цвета. Обладает высокой химической стойкостью. Этот элемент является одним из важнейших металлов, используемых в сталелитейной промышленности.
Хром – важный биогенный элемент, непременно входящий в состав тканей растений, животных и человека. Среднее содержание этого элемента в растениях – 0,0005 %.
Во взрослом человеческом организме содержание хрома колеблется от 6 до 12 мг. Причем достаточно точно физиологическая потребность в хроме для человека не установлена. Принято считать, что человеку требуется в сутки примерно 20–300 мкг этого элемента.
Основные источники отравления хромом:
Хром и его соединения (хромовый ангидрид, окись хрома, хромовая кислота и ее соли, дихромат калия, хромовая смесь) применяются во многих отраслях. Например, в химической, керамической, текстильной и спичечной промышленности, в фотографии, производстве фунгицидов, органических красителей, карандашей, а также как дегазирующее средство. Отравление хромом происходит при поступлении хрома в организм через органы дыхания, пищеварительный аппарат и кожу.
Симптомы отравления:
Соединения хрома оказывают раздражающее и прижигающее действие на слизистые оболочки и кожу. При вдыхании паров наблюдаются раздражение слизистых оболочек, головокружение и озноб, тошнота и рвота, боль в желудке и животе, а также анемия.
При попадании внутрь наблюдаются ожоги пищеварительного аппарата, поражение почек и печени (токсическая желтуха).
Возникают астматические приступы, возрастает частота возникновения рака легких. Так как соединения хрома обладают канцерогенным действием.
Меры предосторожности:
На производстве: наличие вытяжных вентиляционных устройств. Обязательное наличие средств индивидуальной защиты (респираторы, противогазы). Смазывание носовых ходов рыбьим жиром либо смесью животного воска с вазелином. Защита кожи рук применением профилактических мазей перед работой. После работы мытье рук 5% раствором натрия тиосульфата или 10% раствором натрия бисульфата. Предварительные и периодические медицинские осмотры
Ртуть
Ртуть – природный химический элемент, металл, находящийся в жидком состоянии в условиях, которые мы называемым нормальными. Ртуть нужна при изготовлении гальванических элементов (химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите) измерительных приборов (включая термометры и барометры), ламп освещения (энергосберегающих и других). Этот тяжелый металл используют в стоматологии для изготовления некоторых зубных пломб, в косметологии (в частности, при производстве средств для осветления кожи) и в фармакологии.
Ртуть – относительно редкий элемент. В обнаруженных месторождениях находится лишь 0,02% от всего ее объема. Большая же часть ртути рассеяна, преимущественно, в горных породах.
Содержащаяся в земной коре ртуть высвобождается в окружающую среду в результате вулканической деятельности, выветривания скальных пород и, разумеется, в итоге действий человека. Особенно этому способствует выработка энергии на угольных электростанциях, сжигание угля в домах для обогрева и приготовления пищи (уголь содержит ртуть, которая высвобождается при сжигании). Угольные электростанции, котельные и домашние печи «производят» почти половину выделяемой в воздух ртути. Также ртуть попадает в воздух в ходе различных промышленных процессов, при использовании мусоросжигательных установок и т.д.
Люди могут подвергаться воздействию ртути в любой ее форме в разных обстоятельствах.
По информации Всемирной организации здравоохранения вдыхание паров ртути может оказывать вредное воздействие на нервную, пищеварительную и иммунную системы, легкие и почки и может приводить к смерти. Неорганические соли ртути оказывают коррозийное воздействие на кожу, глаза и желудочно-кишечный тракт и могут приводить к интоксикации почек при проглатывании.
Неврологические и поведенческие расстройства могут наблюдаться после вдыхания, проглатывания или кожного контакта с различными соединениями ртути. Симптомы включают тремор, бессонницу, потерю памяти, нервно-мышечные расстройства, головные боли, а также когнитивную и моторную дисфункцию (http://www.who.int/).
Наиболее ядовита не сама металлическая ртуть, а ее пары.. Наиболее опасное воздействие на организм может произойти при вдыхании паров элементарной ртути во время промышленных процессов, а также при употреблении в пищу загрязненных продуктов (рыбы, моллюсков и др.). Попадая в окружающую среду, ртуть под влиянием бактерий может превращаться в метилртуть, которая, в свою очередь, может аккумулироваться в моллюсках и рыбе и далее по пищевой цепочке передаваться человеку.
Самым чувствительным к воздействию ртути является плод человека – ртуть может оказать воздействие на развитие мозга и нервной системы будущего младенца. У детей, которые в утробе матери подвергались воздействию метилртути, могут быть нарушены когнитивное восприятие, мышление, память, внимание, речь, а также мелкая моторика и визуально-двигательная координация.
Сейчас установлено, что наряду с общетоксическим действием (отравлениями) ртуть и ее соединения вызывают гонадотоксический (воздействие на половые железы), эмбриотоксический (воздействие на зародыши), тератогенный (пороки развития и уродства) и мутагенный (возникновение наследственных изменений) эффекты.
Свинец
Это природный токсичный металл, который встречается в земной коре. Широкое применение данного вещества в промышленности привело к масштабному экологическому загрязнению, а также к негативному воздействию на людей.
Главные источники экологического загрязнения – это добыча, выплавка, промышленное производство, использование продукции, содержащей свинец, переработка вторсырья и размещение отходов. Кроме того, в некоторых странах по-прежнему используется свинцовая краска и этилированный бензин (бензин с антидетонационной присадкой – тетраэтилсвинец).
Также свинец применяется при изготовлении краски, витражей, хрустальной посуды, боеприпасов, ювелирных изделий, игрушек, и, кроме того, в некоторых видах косметики. Может представлять опасность и питьевая вода, поступающая через свинцовые трубы или трубы, соединенные свинцовым припоем. Серьезный вред окружающий среде наносят и оставшиеся без утилизации автомобильные аккумуляторы (они также содержат свинец).
Свинец – это вещество, способное накапливаться в человеческом организме. При попадании свинца в кровоток организм ошибочно принимает его за кальций и допускает к жизненно важным «объектам»: клеткам костного мозга, почек и головного мозга. Со временем он также накапливается в зубах и костях.
Особенно уязвимы перед воздействием свинца дети младшего возраста. Из-за присущей детям любознательности и привычке тянуть руки в рот дети кладут в рот и проглатывают свинцовосодержащие или покрытые свинцом предметы, например загрязненную почву или пыль, отслаивающуюся свинцовую краску. Дети, например, могут отковыривать и съедать свинцовую краску со стен, с дверных косяков и мебели.
По некоторым данным, воздействие свинца в детском возрасте является одним из факторов, вызывающих ежегодно порядка 600 тысяч новых случаев развития у детей нарушений умственной деятельности. Это вещество нарушает функционирование мозга и центральной нервной системы, вызывая кому, судороги и даже смерть. Дети, выжившие после тяжелого отравления свинцом, могут страдать от задержки психического развития и необратимых поведенческих расстройств.
Свинец вызывает долгосрочные последствия у взрослых (в том числе — повышенный риск развития гипертонии и повреждение почек). Влияние высокого уровня свинца на беременных женщин: может вызывать выкидыши, мертворождения, преждевременные роды.
Не существует какого-либо известного уровня воздействия свинца, который считается безопасным. Даже такое незначительное содержание свинца в крови, как 5 мкг/дл, что некогда считалось «безопасным уровнем», может приводить к снижению интеллекта у детей, поведенческим трудностям и проблемам в учебе.
При отравлении свинцом наблюдаются следующие симптомы:
- спазматическая боль в животе (как при колике);
- запор, снижение аппетита;
- повышенная раздражительность;
- бледность, вызванная снижением уровня гемоглобина;
- задержка роста;
- задержка развития;
- неспособность надолго удерживать внимание;
- судороги.
Всемирная организация здравоохранения называет свинец одним из 10 химических веществ, вызывающих основную обеспокоенность в области общественного здравоохранения.
В 2009 году Всемирная организация здравоохранения (ВОЗ) и Программа ООН по окружающей среде (ЮНЕП) выступили с инициативой создания Глобального альянса по отказу от применения свинца в красках. Задача Альянса – сосредоточить и активизировать усилия для того, чтобы навсегда исключить возможность попадания свинца из красок в организм детей, а также свести к минимуму воздействие данного металла.
Более широкая цель – содействие поэтапному сокращению производства и продажи красок, содержащих свинец, чтобы, в итоге, ликвидировать связанный с ними риск.
Источник https://ecoportal.su/public/industry/view/1445.html
Источник https://centez.ru/problemy/tyazhelye-metally-obychno-prisutstvuyushchie-v-atmosfere.html
Источник https://ecomuseum.kz/proekty/chemical-safety/problems/hazardous-substances/heavy-metals/